El legado de Max Perutz
M ax Perutz, premio Nobel de qu¨ªmica en 1962 y uno de los fundadores de la biolog¨ªa molecular, muri¨® el pasado mi¨¦rcoles, 6 de febrero. Perutz vio nacer una nueva ciencia y vivi¨® lo suficiente -87 a?os- para comprobar el desarrollo extraordinario que esta iba a tener ya a finales del siglo XX. Su contribuci¨®n fue decisiva, al determinar una de las primeras estructuras tridimensionales de una prote¨ªna.
?Por qu¨¦ fue esto tan importante? Si bien en el ADN est¨¢ contenida la informaci¨®n de los seres vivos, esa informaci¨®n tiene que traducirse en las prote¨ªnas para ser operativa ya que ¨¦stas son las m¨¢quinas que realizan el trabajo de mantenernos vivos. Incluso el mismo ADN es le¨ªdo, reparado, copiado y transferido por las prote¨ªnas. Saber c¨®mo funcionan estas diminutas m¨¢quinas es desentra?ar uno de los secretos de la vida. Pero hay m¨¢s: las prote¨ªnas son las dianas de la mayor parte de los f¨¢rmacos y conocer c¨®mo son ayuda a descubrir nuevos medicamentos. Francis Crick dijo una vez: 'Si quieres comprender la funci¨®n, estudia la estructura'. Eso es exactamente lo que hizo Perutz.
Las estructuras se visualizan ahora en tres dimensiones, en estaciones gr¨¢ficas
Pero situ¨¦monos en 1936, cuando el joven vien¨¦s de 22 a?os Max Perutz, hijo de un industrial de tejidos jud¨ªo, lleg¨® al laboratorio Cavendish de la universidad de Cambridge (Reino unido) para realizar su tesis doctoral bajo la direcci¨®n de John Bernal. Se sab¨ªa, hac¨ªa tiempo, que las prote¨ªnas, a pesar de su descomunal tama?o, pod¨ªan cristalizar. Si una sustancia es capaz de formar un cristal, aunque sea de menos de un mil¨ªmetro, se puede, en principio, resolver su estructura at¨®mica ya que el cristal difracta los rayos X.
Al bombardear un cristal con un fino haz de rayos X, los electrones de los ¨¢tomos de la mol¨¦cula cristalizada dispersan la radiaci¨®n incidente en todas direcciones. Estos rayos dispersados se interfieren y anulan entre s¨ª en la mayor¨ªa de las direcciones del espacio, pero en algunas pocas la interferencia es constructiva y se refuerzan, dando lugar al fen¨®meno de la difracci¨®n.
Si se pone una placa fotogr¨¢fica delante, se ver¨¢ que s¨®lo se ha impresionado en unos puntos espaciados regularmente, que se llaman reflexiones. A partir de la distribuci¨®n e intensidad de estos puntos, se puede reconstruir o ver la estructura molecular de la sustancia cristalizada. Pero el proceso para hacer esta reconstrucci¨®n no es sencillo porque la mitad de la informaci¨®n, la llamada fase de las reflexiones, no se puede medir. La cosa se complica enormemente al crecer el n¨²mero de ¨¢tomos de la mol¨¦cula a estudiar.
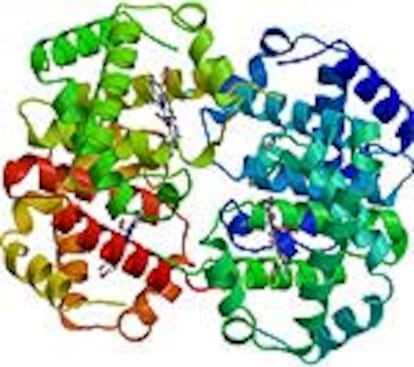
Cuando Perutz lleg¨® a Cambridge la estructura molecular m¨¢s grande que se hab¨ªa resuelto era la del pigmento natural ficocianina, de 58 ¨¢tomos. Una prote¨ªna tiene miles de ¨¢tomos. Bernal, su director, hab¨ªa realizado algunas im¨¢genes de difracci¨®n de rayos X de cristales de una prote¨ªna, la pepsina, pero sin llegar a interpretarlas. El tema escogido por Perutz para su tesis fue otra prote¨ªna, la hemoglobina, el transportador de ox¨ªgeno que da color rojo a nuestra sangre. La hemoglobina tiene nada menos que 11.000 ¨¢tomos.
Para hacerse una idea de la magnitud del proyecto de Perutz, es como si uno se propone escalar el Everest cuando el r¨¦cord mundial de escalada fuera, tan s¨®lo, subir por las escaleras de una casa hasta el quinto piso. Bernal y Perutz no eran unos ilusos, esperaban que la estructura de las prote¨ªnas globulares, como la hemoglobina, fuera repetitiva de forma que no fuera necesario localizar los 11.000 ¨¢tomos, s¨®lo el motivo de repetici¨®n.
Hoy se sabe que las prote¨ªnas globulares -a diferencia de las fibrosas, como la queratina del cabello- no son repetitivas. La cadena polipept¨ªdica que las forma da vueltas y m¨¢s vueltas, se contornea como un espagueti, describiendo una trayectoria impredecible, aunque algunos tramos, como las h¨¦lices, sean muy regulares. No hubo forma de evitarlo: al final se tuvo que escalar todo el Everest.
Hasta los a?os cincuenta Perutz no consigui¨® ning¨²n resultado importante. Un modelo suyo de 1947 muestra lo lejos que estaba de la verdad. Representa la hemoglobina como una caja de sombreros, cil¨ªndrica, con cuatro l¨ªneas circulares que son las cadenas polipept¨ªdicas. El proyecto de Perutz hab¨ªa llegado a un callej¨®n sin salida hasta que, en 1953, ley¨® el trabajo de un bioqu¨ªmico de la universidad de Harvard que describ¨ªa como al tratar la hemoglobina con paramercuriobenzoato no le pasaba nada.
A pesar de tener el mercurio enlazado, la hemoglobina segu¨ªa uniendo ox¨ªgeno. El mercurio, a diferencia de los ¨¢tomos que forman las prote¨ªnas, es un ¨¢tomo pesado, pesa unas diez veces m¨¢s. Perutz tuvo entonces una ocurrencia genial: introdujo mercurio en los cristales de hemoglobina y tom¨® im¨¢genes de difracci¨®n. Compar¨¢ndolas con las de los cristales sin mercurio, vio que la intensidad de algunos puntos de difracci¨®n era diferente. Como la estructura de la hemoglobina presumiblemente no hab¨ªa cambiado, las diferencias se deb¨ªan a la difracci¨®n a?adida de los ¨¢tomos de mercurio.
As¨ª consigui¨® localizar estos ¨¢tomos pesados primero y, con estas marcas en un paisaje confuso, empez¨® a trazar el camino de la prote¨ªna despu¨¦s. En palabras m¨¢s t¨¦cnicas, consigui¨® determinar las fases de las reflexiones o puntos de difracci¨®n. Pero se necesitaban m¨¢s marcas para completarlo -m¨¢s derivados de hemoglobina con otros ¨¢tomos pesados-, y a¨²n tardaron en llegar. El primer mapa de la hemoglobina interpretable no se consigui¨® hasta 1959. Hab¨ªan pasado 23 a?os.
En el banco de datos de prote¨ªnas est¨¢n depositadas, al d¨ªa de hoy, 17.000 estructuras y su n¨²mero se incrementa exponencialmente. Perutz desbroz¨® una v¨ªa que no ha parado de crecer. El proceso de determinaci¨®n de estructuras tridimensionales de prote¨ªnas se ha acelerado considerablemente. Ya no se necesitan 20 a?os de esfuerzo para resolver una estructura y, hoy d¨ªa, se pueden abordar estructuras muy complejas como el ribosoma, que contiene docenas de prote¨ªnas y varias mol¨¦culas de ARN.
?Qu¨¦ es lo que ha cambiado y lo que ha permanecido del m¨¦todo de Perutz? En primer lugar ha cambiado la disponibilidad de prote¨ªna. Antes, s¨®lo las prote¨ªnas mayoritarias o f¨¢ciles de extraer y purificar -como la hemoglobina- se pod¨ªan cristalizar. Hoy, las t¨¦cnicas del ADN recombinante -clonaje, para entendernos- permiten disponer de cualquier prote¨ªna, por minoritaria que sea en la c¨¦lula, si disponemos del gen que la codifica. La secuenciaci¨®n del genoma humano y de otros organismos ha abierto la puerta a determinar masivamente todas las prote¨ªnas codificadas en un genoma.
Por otra parte, la cristalizaci¨®n no ha cambiado mucho. Se sigue haciendo de la misma forma, un poco artesanal, y bastantes prote¨ªnas se niegan a cristalizar sin que sepamos como superar este escollo. Los datos de difracci¨®n de rayos X ya no se recogen con peque?os generadores de rayos X propios. Ahora se usan sincrotrones, enormes aceleradores de electrones que producen radiaci¨®n X de alta intensidad y sintonizable.
Los nuevos detectores de rayos X digitales han suprimido los viejos clich¨¦s fotogr¨¢ficos y la inform¨¢tica ha acelerado el tratamiento de los datos y los c¨¢lculos. Las estructuras se visualizan ahora en tres dimensiones, en estaciones gr¨¢ficas, y los modelos de madera o varillas met¨¢licas han pasado a los museos. Pero, para resolver las estructuras se sigue utilizando el m¨¦todo de Perutz. Con algunas variaciones, la idea b¨¢sica sigue siendo la misma: introducir en la prote¨ªna ¨¢tomos m¨¢s pesados que el carbono, el nitr¨®geno, el ox¨ªgeno, el hidr¨®geno o el azufre que las componen. Un legado extraordinario de un cient¨ªfico de tenacidad fuera de serie.
Miquel Coll es profesor de investigaci¨®n del CSIC

Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripci¨®n de empresa? Accede aqu¨ª para contratar m¨¢s cuentas.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.




























































