El CNIO consigue reprogramar c¨¦lulas madre embrionarias dentro del cuerpo
Su capacidad de diferenciaci¨®n supera la conseguida en el laboratorio El trabajo sugiere la posibilidad futura de autoregeneraci¨®n de tejidos lesionados
Desde que en 2009 se consigui¨® reprogramar simples c¨¦lulas adultas de la piel para transformarlas en c¨¦lulas madre iPS o pluripotentes, tan vers¨¢tiles como las c¨¦lulas madre embrionarias, este procedimiento siempre se hab¨ªa realizado en el laboratorio.
Un equipo del Centro Nacional de Investigaciones Oncol¨®gicas (CNIO) ha demostrado, por vez primera, que el proceso de retrasar el reloj de las c¨¦lulas adultas (reprogramarlas) para convertirlas en iPS se puede provocar tambi¨¦n en el organismo de un ser vivo adulto. Pero, adem¨¢s, estas c¨¦lulas madre, que se han desarrollado en ratones, tienen mayor capacidad de diferenciaci¨®n (de convertirse en distintos tejidos) que las obtenidas en laboratorio. Esta nueva t¨¦cnica no tiene impacto terap¨¦utico directo. Pero permite pensar en un futuro, a¨²n lejano, en el que sean los propios ¨®rganos lesionados los que puedan producir c¨¦lulas madre para regenerarse.
¡°Es un trabajo excepcional¡±, reflexiona Juan Carlos Izpis¨²a, director del Centro de Medicina Regenerativa de Barcelona. ¡°Abre una nueva etapa para la medicina, la b¨²squeda de estrategias que nos permitan regenerar ¨®rganos y tejidos de una forma similar a los procesos naturales¡±.
El trabajo del grupo de Manuel Serrano, director del programa de Oncolog¨ªa Molecular del CNIO, lo publica Nature y parte de la t¨¦cnica que le permiti¨® al investigador japon¨¦s Shinya Yamanaka obtener c¨¦lulas madre iPS en 2007 y el Nobel en 2012.
Yamanaka reprogram¨® las c¨¦lulas adultas introduciendo en ellas cuatro genes caracter¨ªsticos de la etapa embrionaria, de forma que, al activarse, devuelven a la c¨¦lula a un estadio pr¨¢cticamente igual al de una c¨¦lula embrionaria, convirti¨¦ndola en la famosa iPS. Serrano ha usado la misma combinaci¨®n de genes, el llamado coctel Yamanaka, pero le ha dado varias vueltas de tuerca, con unos resultados sorprendentes e inesperados.
El equipo del investigador espa?ol dise?¨® un rat¨®n al que introdujo un gen artificial que, en respuesta a la administraci¨®n de un antibi¨®tico ¡ªtetraciclina¡ª se activa y produce el mismo efecto que el coctel de las cuatro prote¨ªnas de Yamanaka.
La intenci¨®n original de Serrano no era generar c¨¦lulas madre iPS en el interior de los roedores, sino algo ¡°mucho m¨¢s prosaico¡±, como traslada a este diario. Buscaba una forma sencilla de obtener c¨¦lulas madre embrionarias. Y la forma de conseguirlas era extraer las c¨¦lulas de los ratones con el genoma modificado, ba?arlas en una placa de laboratorio con el antibi¨®tico y generar f¨¢cilmente cultivos de c¨¦lulas iPS.
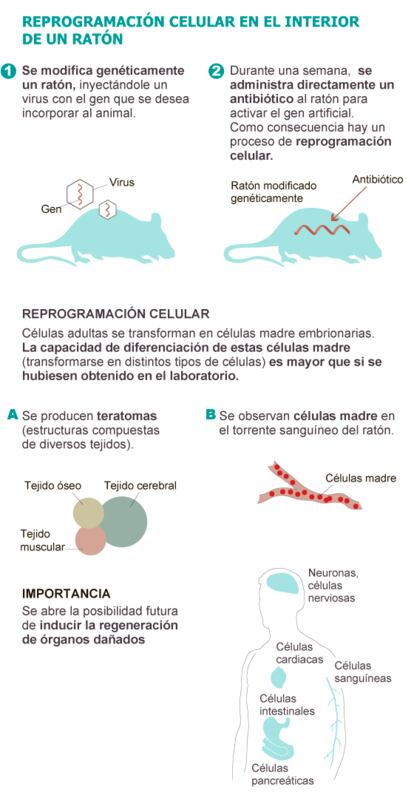
Pero en un momento dado, le surgi¨® la duda. ?Que suceder¨ªa si se administraba el antibi¨®tico directamente al rat¨®n modificado gen¨¦ticamente y no a los cultivos de sus c¨¦lulas? ¡°Sinceramente, no confi¨¢bamos en que las c¨¦lulas se fueran a reprogramar dentro del rat¨®n¡±, traslada el investigador. "No cre¨ªamos que funcionara¡±, insiste. Pero funcion¨®.
Los ratones modificados de Serrano bebieron el antibi¨®tico diluido en agua durante una semana. Al poner en marcha el mecanismo descrito por Yamanaka y adaptado por el CNIO, los investigadores observaron que c¨¦lulas adultas de los ratones perd¨ªan sus caracter¨ªsticas y adquir¨ªan rasgos de c¨¦lulas embrionarias ¡°que no existen en los organismos adultos¡±, destaca Serrano.
Tras retroceder, desprogramarse y convertirse en c¨¦lulas madre, las c¨¦lulas se replicaban de forma descontrolada y desordenada en el interior del cuerpo de los roedores dando lugar a una especie de masa compuesta de diferentes tejidos (cerebral, muscular, ¨®seo, intestinal...) de tejidos. Una especie de embri¨®n desorganizado denominado teratoma.
La importancia de estas estructuras pseudoembrionarias que aparec¨ªan por decenas en el t¨®rax y en el abdomen no est¨¢ en su utilidad cl¨ªnica. Ninguna terapia puede pasar por provocar teratomas. Lo relevante es que de esta forma quedaba patente la elevada capacidad de diferenciaci¨®n de las c¨¦lulas madre generadas en el interior de los ratones. Estas estructuras no solo conten¨ªan c¨¦lulas derivadas del desarrollo del embri¨®n (de las tres capas que lo conforman), sino incluso de tejidos externos al embri¨®n, como es el caso de saco vitelino.
Adem¨¢s, los investigadores del CNIO detectaron c¨¦lulas madre en el torrente sangu¨ªneo de los ratones tratados
En ambos casos ¡ªtanto en los teratomas como en la sangre¡ª las c¨¦lulas madre obtenidas presentaban unos estadios embrionarios a¨²n m¨¢s tempranos que las c¨¦lulas producidas mediante la t¨¦cnica de Yamanaka. Es decir, hab¨ªan retrocedido a un nivel m¨¢s primitivo, por lo que presentaban una mayor facultad de diferenciaci¨®n en diferentes tipos celulares. Presentaban caracter¨ªsticas de embriones humanos de tan solo 72 horas de gestaci¨®n y 16 c¨¦lulas, que en la jerga se denominan rasgos totipotentes.
Estas caracter¨ªsticas de indiferenciaci¨®n tan elevadas ¡°nunca se hab¨ªan generado en el laboratorio", seg¨²n los autores. ¡°Estos datos nos indican que nuestras c¨¦lulas madre son mucho m¨¢s vers¨¢tiles que las c¨¦lulas iPS de Yamanaka¡±, destaca Serrano. La contrapartida de esta facultad es que las c¨¦lulas son m¨¢s dif¨ªciles de controlar cuando llega el momento de convertirlas en tejidos concretos.
El objetivo de la medicina regenerativa consiste en curar ¨®rganos da?ados a trav¨¦s de c¨¦lulas sanas. La materia prima de este enfoque terap¨¦utico son las c¨¦lulas madre por su capacidad de convertirse en cualquiera de los m¨¢s de 100 tipos celulares. Los especialistas aspiran a poder manipular estas c¨¦lulas desprogramadas para convertirlas en c¨¦lulas sanas de h¨ªgado, coraz¨®n o p¨¢ncreas con las que tratar insuficiencias hep¨¢ticas, infartos o diabetes. O incluso desarrollar en el laboratorio ¨®rganos completos de repuesto para sustituir a los enfermos.
Las c¨¦lulas iPS cumplen estas condiciones de versatilidad. Y, adem¨¢s, no plantean los problemas ¨¦ticos que si presentan las c¨¦lulas madre embrionarias humanas. Por ello, los investigadores del CNIO plantean que la nueva fuente de c¨¦lulas madre que han descrito puede constituir una fuente alternativa a las que se obtienen en el laboratorio para la investigaci¨®n en medicina regenerativa. ¡°Nuestras c¨¦lulas madre sobreviven tambi¨¦n en cultivos fuera de los ratones¡±, apunta Mar¨ªa Abad, primera autora del art¨ªculo.
Pero existe otra futura aplicaci¨®n terap¨¦utica m¨¢s atractiva, aunque cuya aplicaci¨®n se muestra mucho m¨¢s remota. Se tratar¨ªa de aprovechar la capacidad de crear c¨¦lulas madre dentro del cuerpo para inducir la regeneraci¨®n end¨®gena en un ¨¢rea da?ada.
En los procesos naturales de regeneraci¨®n, las c¨¦lulas sanas dirigen a las c¨¦lulas reparadoras. En el trabajo de los investigadores espa?oles, como explica Serrano, la diferenciaci¨®n inducida en las c¨¦lulas adultas era tan alta que las c¨¦lulas madre eran insensibles a las se?ales del entorno y desarrollaban teratomas.
Uno de los pr¨®ximos objetivos de los investigadores del CNIO consiste en determinar si existe un grado de diferenciaci¨®n que permita a las c¨¦lulas madre iPS generadas interactuar con su entorno y reparar por s¨ª mismas, desde dentro, el tejido lesionado. "Vamos a provocar da?os en ratones, un infarto por ejemplo, y administrar menos medicaci¨®n, de forma que exista un menor grado de reprogramaci¨®n celular", comenta el investigador. ¡°Queremos observar si esas c¨¦lulas menos diferenciadas pueden dar lugar a cardiomiocitos que mejoren la funci¨®n cardiaca¡±.
Este cambio de concepto, el de inducir la regeneraci¨®n terap¨¦utica en lugar de crear tejidos de repuesto en el laboratorio, evitar¨ªa riesgos derivados de las intervenciones quir¨²rgicas a las que se deber¨ªan someter los pacientes para recibir los ¨®rganos y tejidos reparadores. O accidentes en la manipulaci¨®n de los cultivos, entre otros.
El grupo de Serrano no es el primero en plantear este enfoque. Un trabajo del Centro de Medicina Regenerativa de Barcelona y el Instituto Salk anunci¨® hace casi dos meses una nueva f¨®rmula para generar iPS en el laboratorio. En lugar de la receta Yamanaka (que consiste en despertar cuatro genes activos en la etapa embrionaria, dos de los cuales inducen a la formaci¨®n de tumores), este grupo desarroll¨® un c¨®ctel alternativo que pasaba por alterar otros siete genes que ya est¨¢n activos en las c¨¦lulas adultas. Ello abr¨ªa la posibilidad reajustar la expresi¨®n de estos genes dentro del cuerpo para que generaran c¨¦lulas madre reparadoras en los propios tejidos. La misma idea de la regeneraci¨®n end¨®gena ¨®rgano planteada por Serrano.
Todos estos planteamientos de la medicina regenerativa suenan a¨²n a ciencia ficci¨®n. Y lo son. Aunque cada vez menos. Jap¨®n aprob¨® en junio el primer intento de llevarlos a la pr¨¢ctica. Autoriz¨® un ensayo para crear retinas con c¨¦lulas iPS para implantarlas en ciegos con degeneraci¨®n macular.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripci¨®n de empresa? Accede aqu¨ª para contratar m¨¢s cuentas.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.





























































