El mayor mapa gen¨¦tico del c¨¢ncer
El genoma de los grandes tipos de tumores revoluciona el conocimiento de la enfermedad Los investigadores logran catalogar las mutaciones no heredadas
Ning¨²n onc¨®logo cree a estas alturas que el equivalente moderno del doctor Fleming vaya a descubrir la penicilina contra el c¨¢ncer, alg¨²n tipo de f¨¢rmaco o procedimiento m¨¦dico de aplicaci¨®n general que suponga el verdadero vuelco en el tratamiento antitumoral, que convierta al matarife en una enfermedad curable o, al menos, cr¨®nica y controlable. No va a haber una penicilina del c¨¢ncer, y ya nadie la est¨¢ buscando.
Pero la mitad de los c¨¢nceres ya se curan, como repite sin cesar cualquier onc¨®logo. Y la guerra contra la otra mitad se est¨¢ librando ahora mismo en dos frentes esenciales. Uno se refiere al tema eterno del diagn¨®stico precoz, que pese a sus or¨ªgenes prehist¨®ricos no ha perdido un ¨¢pice de importancia en nuestros d¨ªas. Y el otro es la gen¨®mica, el nuevo cuerpo de conceptos y tecnolog¨ªas del ADN que est¨¢ revolucionando la biolog¨ªa en su conjunto, y la investigaci¨®n del c¨¢ncer en particular.
Con ser una disciplina nueva, la gen¨®mica del c¨¢ncer va cumpliendo un decenio y ha vertido ya un Iguaz¨² de nuevos conocimientos sobre la oncolog¨ªa, siempre sedienta de ellos. Los primeros esfuerzos en gen¨®mica del c¨¢ncer se centraron en las mutaciones heredadas que confieren una alta propensi¨®n a la enfermedad. Este tipo de alteraciones heredadas (o mutaciones de la l¨ªnea germinal, en la jerga) son al fin y al cabo la gran especialidad de la gen¨¦tica desde sus or¨ªgenes en el huerto conventual de Gregor Mendel.
Pero el gran avance de las t¨¦cnicas de secuenciaci¨®n de ADN ¡ªy sobre todo su acelerado abaratamiento¡ª ha permitido ahora catalogar las mutaciones som¨¢ticas (no heredadas, sino surgidas en el cuerpo del adulto) que dirigen el crecimiento de los principales tipos de tumores. Los grandes cerebros del sector dan cuenta del estado de la cuesti¨®n en cuatro art¨ªculos de la revista Science y dos n¨²meros especiales de su subsidiaria Science Signalling. Los datos revelan un fil¨®n de nuevas v¨ªas abiertas para el tratamiento de los principales tipos de tumores.
Uno de los grandes problemas de la lucha antitumoral, se dice a menudo, es que el c¨¢ncer no es una enfermedad, sino 200 distintas. Esta es una de las razones de que nadie espere la p¨ªldora del doctor Fleming, y el alud de datos de la gen¨®mica moderna ha empeorado a¨²n m¨¢s el cuadro. La primera impresi¨®n que ofreci¨® ese atrac¨®n de secuencias gen¨¦ticas (gaatgtta¡) fue que no solo hab¨ªa 200 enfermedades distintas, sino que encima cada enfermo es un mundo.
Cuatro trabajos en ¡®Science¡¯ revelan un fil¨®n de v¨ªas abiertas
Pero los conceptos generales han empezado a emerger de esas pormenorizadas espesuras, y con ellos las nuevas estrategias para el tratamiento. La historia de la ciencia muestra que el entendimiento es el pr¨®logo de la esperanza.
¡°Hace 10 a?os¡±, dicen Bert Vogelstein y sus colegas del Instituto M¨¦dico Howard Hughes en Baltimore, ¡°la idea de que todos los genes alterados en el c¨¢ncer pudieran ser identificados con la resoluci¨®n de un par de bases habr¨ªa parecido ciencia ficci¨®n¡±. Lo del ¡°par de bases¡± no es una concesi¨®n de Vogelstein a la indeterminaci¨®n literaria. Es la mayor precisi¨®n que se puede alcanzar en biolog¨ªa: detectar, entre los 3.000 millones de letras del ADN que contiene cada una de nuestras c¨¦lulas, una errata en una sola letra que tiene efectos cancerosos.
Ese an¨¢lisis de amplitud gen¨®mica ahora no es solo posible, sino incluso una mera ¡°rutina¡±, en palabras de Vogelstein, en los laboratorios avanzados de investigaci¨®n oncol¨®gica que salpican el planeta. Vogelstein, premio Pr¨ªncipe de Asturias en 2004 por sus contribuciones a la gen¨¦tica del c¨¢ncer, es tambi¨¦n uno de los grandes pioneros de la gen¨®mica del c¨¢ncer, o aplicaci¨®n de las nuevas tecnolog¨ªas de secuenciaci¨®n (lectura) del ADN a la lucha contra esa enfermedad (o esas 200 enfermedades distintas). Quiz¨¢ no sea casual que su primera licenciatura no la obtuviera en Biolog¨ªa, sino en Matem¨¢ticas.
El abaratamiento de las lecturas de ADN ha facilitado los progresos
Por poco cient¨ªfico que suene, los costes han sido la cuesti¨®n capital para este progreso. Cuando se empezaron a estudiar los primeros genomas del c¨¢ncer ¡ªque fueron los de colon y mama, hace unos 10 a?os¡ª, secuenciar un tumor de cada paciente costaba unos 100.000 d¨®lares (78.000 euros al cambio actual); el coste ronda ahora los 1.000 d¨®lares (780 euros).
Como consecuencia, las investigaciones que presentan de una tacada los genomas de 100 tumores de cierto tipo (mama, piel u otros tejidos) ¡°se han convertido en la norma¡±, seg¨²n los genetistas del Howard Hughes. El diluvio de datos es abrumador y no tiene el m¨¢s remoto precedente en la investigaci¨®n oncol¨®gica. Los investigadores esperan que ese salto cuantitativo ascienda a cualitativo en los pr¨®ximos a?os. Ya lo es para el conocimiento del c¨¢ncer y el objetivo es que pronto lo sea tambi¨¦n para el tratamiento.
La gen¨®mica ha descubierto que los principales c¨¢nceres humanos se deben a la acumulaci¨®n de unas pocas mutaciones ¡ªentre dos y ocho¡ª que se van sumando serialmente a lo largo de 20 o 30 a?os. Alguna de esas mutaciones puede venir puesta de nacimiento, confiriendo a esa persona una alta propensi¨®n a desarrollar uno u otro tipo de tumor, o incluso cualquier tipo de tumor.
Pero lo habitual es que las mutaciones surjan a lo largo de la vida del individuo, y en algunos c¨¢nceres la causa no puede estar m¨¢s clara. Es el caso del humo del tabaco para el c¨¢ncer de pulm¨®n, o el de la radiaci¨®n ultravioleta de la luz solar para el c¨¢ncer de piel. Estos dos c¨¢nceres, de hecho, son algunos de los que m¨¢s mutaciones exhiben de todos los examinados por la gen¨®mica. A lo largo de los 20 o 30 a?os que tardan en desarrollarse, estos tumores se benefician grandemente de la persistencia en los h¨¢bitos fumadores o solariegos de sus portadores.
La mayor¨ªa de los c¨¢nceres dependen de unas pocas mutaciones
Esas pocas mutaciones (de dos a ocho) que se acumulan durante dos d¨¦cadas son cancerosas en un sentido muy expl¨ªcito: cada una de ellas, por s¨ª misma, incrementa el ritmo de divisi¨®n celular (o reduce el de muerte celular, o ambas). La c¨¦lula que sufre la mutaci¨®n adquiere as¨ª una ventaja competitiva sobre sus c¨¦lulas vecinas. Aun cuando la ventaja sea peque?a en cada generaci¨®n celular, su efecto acumulativo a lo largo de los a?os suele producir un clon de c¨¦lulas mutadas en alg¨²n ¨®rgano del paciente.
Una peca es un ejemplo intuitivo de uno de estos clones (recuerden que la piel es un ¨®rgano), y tambi¨¦n ilustra el hecho de que una sola mutaci¨®n no suele ser maligna. Lo que s¨ª genera es un campo amplificado de c¨¦lulas sobre las que sembrar la siguiente mutaci¨®n. En estas condiciones, no hace falta postular ning¨²n mecanismo especial para la acumulaci¨®n de mutaciones en una sola c¨¦lula. El viejo y venerable azar se basta por s¨ª solo para acabar complicando las cosas.
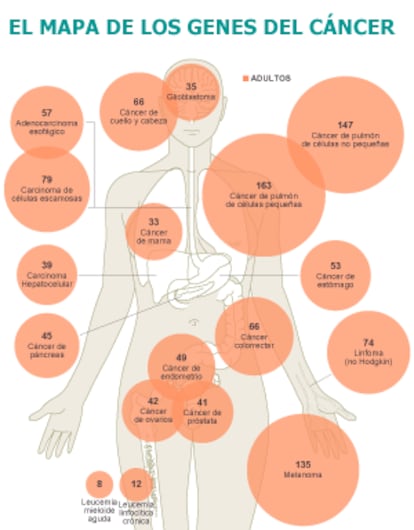
Por desgracia ¡ªy como cab¨ªa esperar, por otro lado¡ª esas dos u ocho mutaciones cr¨ªticas no son las mismas en todos los c¨¢nceres. Con algunas excepciones, tienden a ser espec¨ªficas de cada tipo de tumor. Esta es la raz¨®n de que no haya ocho genes del c¨¢ncer, sino 140. Son lo que los investigadores llaman genes conductores, genes cuyas alteraciones (mutaciones) confieren a la c¨¦lula que las sufre una ventaja selectiva en su competitivo vecindario celular, y que por tanto dirigen o conducen el desarrollo del tumor.
El t¨¦rmino conductores sirve para distinguirlos de la vasta mayor¨ªa de genes que aparecen mutados en cualquier tumor, que son meros pasajeros: alteraciones oportunistas que se ven amplificadas en el cuerpo por el mero hecho de que ocurren en el mismo genoma ¡ªen el mismo autob¨²s¡ª que las mutaciones en los genes conductores.
La clave de los tumores est¨¢ en una docena de sistemas biol¨®gicos
E incluso esa cifra algo abultada de 140 genes conductores esconde una simplicidad subyacente que permitir¨¢ en el futuro inmediato, si no lo est¨¢ haciendo ya, concentrar los focos en las t¨¢cticas farmacol¨®gicas m¨¢s prometedoras a corto plazo. Porque esos 140 genes son componentes de solo 12 sistemas biol¨®gicos muy bien caracterizados en las c¨¦lulas humanas.
Son los sistemas de transmisi¨®n (transducci¨®n de se?al, en la jerga) que comunican el entorno de la c¨¦lula ¡ªqu¨¦ hormonas circulan por la sangre, o qu¨¦ andan haciendo las c¨¦lulas vecinas en ese momento¡ª con su sede central de inteligencia: el n¨²cleo celular donde el genoma reside, se replica, brega con el estr¨¦s y ocasionalmente muta.
En un organismo multicelular como el lector, es este avanzado sistema de comunicaciones entre las partes de una c¨¦lula el que determina su destino: cu¨¢ndo debe dividirse o morir, si se debe convertir en una neurona o una c¨¦lula de la piel o, por el contrario, preservar su naturaleza inmadura de c¨¦lula madre para seguirse dividiendo sin comprometerse a un destino o a otro.
En ocasiones, si ha de dividirse m¨¢s deprisa que las dem¨¢s. Ah¨ª est¨¢ la esencia molecular del c¨¢ncer, y posiblemente ¡ªesperan los genetistas¡ª su tal¨®n de Aquiles.
De este modo, la gen¨®mica, que empez¨® complicando las cosas m¨¢s de lo que ya lo estaban en la investigaci¨®n del c¨¢ncer, ha empezado a pagar su deuda con la simplicidad, o con la esperanza de que haya algunos principios generales bajo la espesura de lo prolijo. Pese a que cada tumor, incluso en comparaci¨®n con los de su mismo tipo y subtipo, sea un mundo con un paisaje gen¨¦tico ¨²nico e irrepetible ¡ªy en ese sentido un producto de la historia¡ª, los sistemas de comunicaci¨®n intracelular afectados son similares en distintos tumores, e incluso entre distintos tipos de tumor.
¡°En el futuro¡±, dicen Vogelstein y sus colegas, ¡°el mejor plan de gesti¨®n para un paciente con c¨¢ncer estar¨¢ basado en un an¨¢lisis del genoma de su l¨ªnea germinal (el que ha heredado de sus padres) y el genoma de su tumor¡±. Y el futuro empieza hoy.
Mensaje para investigadores
El mapa de las mutaciones asociadas a cada c¨¢ncer da una muestra de su extraordinaria variabilidad. No es solo que el tumor de mama no tiene nada que ver con una leucemia. Es que dentro de cada tipo hay varios subtipos. Y cada uno de estos necesita una terapia espec¨ªfica. Esto llega al extremo en uno de los m¨¢s estudiados por ser el m¨¢s frecuente en hombres, el de pulm¨®n. Ya los propios autores de los trabajos que publica Science distinguen entre los tumores de c¨¦lulas peque?as y los de no peque?as.
Estas diferencias son cruciales en el diagn¨®stico y el tratamiento. Los onc¨®logos m¨¦dicos ya defienden abiertamente que ante un diagn¨®stico de c¨¢ncer, lo primero que habr¨ªa que hacer ser¨ªa un estudio gen¨®mico del paciente.
?Es caro? Seg¨²n se mire. A menos de 800 euros por persona puede resultar mucho m¨¢s barato que una cirug¨ªa, una quimioterapia o un tratamiento de ¨²ltima generaci¨®n a base de f¨¢rmacos de origen biol¨®gico. Y tiene una doble ventaja: al sacar la huella dactilar del c¨¢ncer, se sabe exactamente qu¨¦ tratamientos hay que suministrar. Es lo que se denomina terapia personalizada, ya que depende de los genes de cada uno (aunque luego, en la pr¨¢ctica, lo que se haga sea meter a cada paciente en un grupo con las mismas mutaciones). Esto es bueno para el paciente, que se va a beneficiar de lo m¨¢s adecuado. Pero esto, adem¨¢s, es bueno tambi¨¦n para el sistema sanitario. No tiene sentido gastar dinero (y hablamos de miles de euros) en dar una quimioterapia oral a una persona cuyos genes est¨¢n preparados para eludir su efecto. Mucho menos cuando al hacer esto muchas veces hay que acompa?ar la medicaci¨®n de otras pastillas para los efectos secundarios (n¨¢useas, anemia, malestar). Y eso es m¨¢s gasto.
Los trabajos publicados en Science tienen otra ventaja. Al establecer que un pu?ado de mutaciones intervienen en la mayor¨ªa de los c¨¢nceres, las sit¨²an en la diana de los investigadores. Es por donde conviene empezar.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.

































































