La qu¨ªmica para entender y combatir el alzh¨¦imer
Los cient¨ªficos est¨¢n descifrando la estructura de las prote¨ªnas amiloides que forman las placas caracter¨ªsticas de la enfermedad, paso importante para poder dise?ar f¨¢rmacos en el futuro
Este a?o se celebra el A?o Internacional de la Qu¨ªmica y de la enfermedad de alzh¨¦imer. Es pues el momento ideal para destacar la contribuci¨®n de la qu¨ªmica al estudio de las bases moleculares de uno de los procesos claves de la enfermedad de alzh¨¦imer: la agregaci¨®n de la prote¨ªna beta-amiloide.
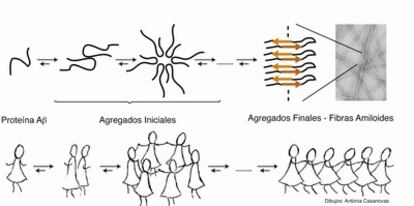
La historia empieza en 1906, cuando Alois Alzh¨¦imer descubri¨® en el cerebro de Auguste Deter, enferma de lo que hoy conocemos como alzh¨¦imer, unas acumulaciones an¨®malas de prote¨ªnas denominadas placas amiloides. Ochenta a?os m¨¢s tarde se determin¨® que estas placas estaban formadas mayoritariamente por una prote¨ªna llamada beta-amiloide (A?). En el cerebro de los enfermos de alzh¨¦imer, la prote¨ªna A? se encuentra agregada. La agregaci¨®n es un proceso durante el cual una misma mol¨¦cula tiene tendencia a asociarse consigo misma dando lugar a especies de mayor tama?o. En el caso de la prote¨ªna A?, este proceso de agregaci¨®n pasa por distintos intermedios formados por asociaciones de distinto n¨²mero de mol¨¦culas de prote¨ªna hasta dar lugar al agregado final que se conoce como fibras amiloides. Las fibras son el componente mayoritario de las placas amiloides descritas por Alois Alzh¨¦imer y tienen una forma similar a espaguetis. Durante los a?os 1985 y 1991, utilizando distintas disciplinas, se obtuvieron resultados muy alentadores que dieron lugar a la hip¨®tesis amiloide, seg¨²n la cual la agregaci¨®n de la prote¨ªna A? en forma de fibras era la causa de la enfermedad de alzh¨¦imer.
Al formularse la hip¨®tesis amiloide, se consider¨® como posible estrategia terap¨¦utica la inhibici¨®n de la formaci¨®n de fibras amiloides. Para que los qu¨ªmicos podamos dise?ar nuevos f¨¢rmacos nos es muy importante conocer la estructura, es decir, la disposici¨®n de los ¨¢tomos en el espacio de la mol¨¦cula que ha de interaccionar con nuestro f¨¢rmaco, en este caso la fibra. En aquel momento se desconoc¨ªa la estructura tridimensional de las fibras pero, afortunadamente, ya se conoc¨ªan algunas de sus caracter¨ªsticas estructurales globales como que las mol¨¦culas de prote¨ªna A? se encuentran unidas entre s¨ª mediante enlaces de hidr¨®geno. Nos lo podemos imaginar como si la prote¨ªna A? fuese una persona y se dispusiera a bailar la conga. En este momento, la persona tiene dos caras: los brazos para agarrarse a una persona y la espalda donde se agarra otra. As¨ª una misma mol¨¦cula de prote¨ªna puede unirse a otras dos y estas dos a otra dos y as¨ª sucesivamente hasta formar largas estructuras fibrilares que contienen hasta 4000 mol¨¦culas de prote¨ªna. Los qu¨ªmicos dise?aron mol¨¦culas que reconocieran a la prote¨ªna A? pero que s¨®lo pudieran interaccionar con una de sus caras, y as¨ª dise?aron mol¨¦culas a las que por ejemplo les faltasen los brazos, bloqueando as¨ª la formaci¨®n de fibras.
Mientras tanto, y de forma paralela a estos estudios, se iban conociendo datos que indicaban que el n¨²mero de dep¨®sitos amiloides, y por lo tanto de fibras presentes en el cerebro de los enfermos de alzh¨¦imer, no se correlacionaban con el deterioro cognitivo de los pacientes. Es aqu¨ª cuando en el 2002, la hip¨®tesis amiloide se reformul¨® estableciendo que en lugar de los agregados finales (las fibras), los causantes de la enfermedad eran los agregados que se formaban en los estadios iniciales del proceso de agregaci¨®n. En este sentido, los inhibidores antes desarrollados ten¨ªan que volverse a evaluar puesto que pod¨ªan tener un efecto contraproducente: evitar la formaci¨®n de fibras provocando la acumulaci¨®n de agregados iniciales, ahora propuestos como los causantes de la enfermedad.
Para dise?ar f¨¢rmacos que destruyan o eviten la formaci¨®n de estos agregados iniciales necesitamos conocer su estructura. Esta informaci¨®n es mucho m¨¢s dif¨ªcil de obtener para los agregados iniciales que para los finales. Los agregados iniciales tienen una naturaleza heterog¨¦nea y din¨¢mica, es decir, son muy diferentes entre s¨ª y cambian en funci¨®n del tiempo. Podr¨ªamos comparar a los agregados finales -las fibras- con un d¨ªa de Fiesta Mayor donde tocan la conga y todos la bailan en filas, mientras que comparar¨ªamos a los agregados iniciales con una concurrida discoteca donde la gente baila en grupos de dos, de tres, de seis...
Durante estos a?os la qu¨ªmica est¨¢ siendo decisiva en la caracterizaci¨®n estructural de los agregados iniciales. Por un lado nos proporciona herramientas, reacciones qu¨ªmicas, que permiten estabilizar los agregados iniciales: la qu¨ªmica act¨²a parando la m¨²sica, dej¨¢ndolos congelados en una determinada posici¨®n lo que nos da m¨¢s tiempo para estudiarlos. La qu¨ªmica tambi¨¦n nos ha proporcionado estrategias de marcaje: si mientras bailamos nos tiran confeti, dependiendo de c¨®mo estemos dispuestos al bailar ciertas partes de nuestro cuerpo quedar¨¢n m¨¢s manchadas que otras. Por ejemplo, si estamos bailando la conga el pelo y las piernas nos quedar¨¢n m¨¢s manchadas de confeti que la espalda y el abdomen. La qu¨ªmica nos permite aplicar la misma t¨¦cnica a los agregados iniciales utilizando, en lugar de confeti, marcajes con distintos is¨®topos (¨¢tomos de un mismo elemento con distintas propiedades). De esta manera podemos conocer qu¨¦ regiones de la prote¨ªna A? son inaccesibles al confeti isot¨®pico, lo que equivaldr¨ªa a decir que son regiones m¨¢s plegadas y con mayor estructura tridimensional, y qu¨¦ regiones son accesibles al confeti isot¨®pico y por lo tanto se encuentran en la superficie del agregado, y as¨ª obtener informaci¨®n estructural de estas formas tan relevantes en la enfermedad de alzh¨¦imer: los agregados iniciales.
Nuestro trabajo -y el de muchos otros laboratorios- pretende avanzar significativamente en la elucidaci¨®n estructural de los agregados iniciales de la prote¨ªna A?. Cuando conozcamos detalles estructurales de estos agregados iniciales volveremos a utilizar la qu¨ªmica para dise?ar y sintetizar nuevas mol¨¦culas que o bien impidan su formaci¨®n o bien modifiquen su estructura hacia formas no t¨®xicas para as¨ª contribuir al desarrollo de estrategias terap¨¦uticas que permitan prevenir y curar esta devastadora enfermedad.
Nat¨¤lia Carulla es Investigadora Ram¨®n y Cajal en el Instituto de Investigaci¨®n Biom¨¦dica (IRB) de Barcelona
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.
































































