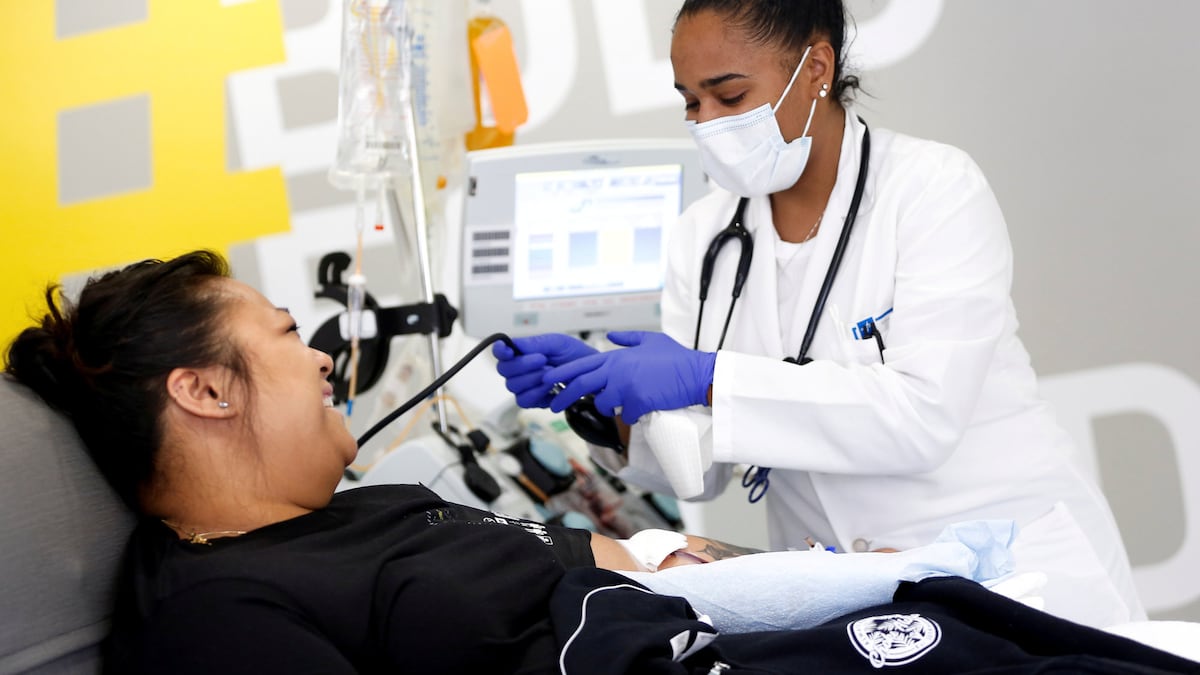
EE UU aprueba el tratamiento con transfusiones de plasma para pacientes con coronavirus
Los primeros estudios se?alan que un 35% de los enfermos se recupera tras recibir el tratamiento

La Administraci¨®n de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en ingl¨¦s) ha autorizado de emergencia el uso de plasma como tratamiento para los pacientes con coronavirus. La agencia federal ha analizado en los ¨²ltimos meses los resultados de enfermos que han recibido transfusiones del componente l¨ªquido de la sangre de pacientes que se han recuperado de la enfermedad. El plasma contiene un alto nivel de anticuerpos que, seg¨²n los an¨¢lisis de la agencia, ayudan a la recuperaci¨®n del paciente en algunos casos.
La agencia hab¨ªa detenido la autorizaci¨®n la semana pasada asegurando que los resultados de las investigaciones no hab¨ªan sido concluyentes. Este domingo, la FDA ha asegurado que analiz¨® los resultados de 20.000 pacientes que recibieron transfusiones de plasma. Estos ten¨ªan menos de 80 a?os, hab¨ªan sido hospitalizados y a¨²n no utilizaban un ventilador como ayuda para respirar. La agencia se?ala que al menos un 35% de los enfermos tuvieron una recuperaci¨®n favorable tras recibir el tratamiento. En Estados Unidos se estima que a unas 70.000 personas con la covid-19 ya les ha sido administrada una transfusi¨®n de plasma de un paciente recuperado.
Este domingo, la FDA ha dado un r¨¢pido y s¨²bito giro para permitir el uso del tratamiento. ¡°Los estudios realizados este a?o muestran que el plasma de los pacientes que se han recuperado de la covid-19 tienen el potencial de ayudar a tratar a aquellos pacientes que est¨¢n sufriendo por los efectos de este terrible virus¡±, explic¨® Stephen Hahn, comisionado de la FDA. Los estudios sobre el tratamiento todav¨ªa est¨¢n en curso por lo que la agencia federal se ha comprometido a actualizar su autorizaci¨®n.
Hasta ahora el ¨²nico tratamiento que hab¨ªa sido autorizado por la FDA era el antiviral experimental remdesivir, elaborado por la compa?¨ªa farmac¨¦utica Gilead, y que recibi¨® luz verdad en Estados Unidos en mayo. El medicamento fue creado para tratar el ¨¦bola y la hepatitis, pero no dio resultados satisfactorios. Frente a la covid-19, el f¨¢rmaco act¨²a como un bloqueador del virus cuando entra al cuerpo humano. Hasta ahora en Estados Unidos se han presentado 5,6 millones de casos y 176.000 personas han muerto por la enfermedad.
La ¨²ltima autorizaci¨®n ha sido anunciada este domingo por Donald Trump en la Casa Blanca. El presidente estadounidense hab¨ªa atacado esta semana en Twitter a la agencia por supuestamente impedir que la vacuna contra el coronavirus est¨¦ disponible para los estadounidenses antes del 3 de noviembre, el d¨ªa de las elecciones presidenciales. ¡°La FDA est¨¢ haciendo muy dif¨ªcil que las compa?¨ªas farmac¨¦uticas lleguen a la gente para hacer las pruebas con las vacunas¡±, escribi¨® Trump en su cuenta de Twitter. Tras la presi¨®n del presidente, la agencia ha cedido.
Informaci¨®n sobre el coronavirus
- Aqu¨ª puede seguir la ¨²ltima hora sobre la evoluci¨®n de la pandemia
- As¨ª evoluciona la curva del coronavirus en Espa?a y en cada autonom¨ªa
- Buscador: La nueva normalidad por municipios
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripci¨®n de empresa? Accede aqu¨ª para contratar m¨¢s cuentas.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.
Sobre la firma