El problema de la amiloidosis: m¨¢s all¨¢ del alzh¨¦imer y el p¨¢rkinson
La placa amiloide puede acumularse en otros ¨®rganos del cuerpo, adem¨¢s del cerebro. Las enfermedades resultantes causan mucho sufrimiento
Isabelle Lousada ten¨ªa poco m¨¢s de 30 a?os cuando colaps¨® en su boda en Filadelfia en 1995. Lousada, arquitecta londinense, hab¨ªa sufrido una d¨¦cada de s¨ªntomas misteriosos: hormigueo en los dedos, tobillos hinchados y vientre distendido por su h¨ªgado agrandado. Los m¨¦dicos a los que consult¨® inicialmente sugirieron que ten¨ªa s¨ªndrome de fatiga cr¨®nica, o que hab¨ªa estado de fiesta y bebiendo demasiado.
Pero su nuevo cu?ado, cardi¨®logo de profesi¨®n, intuy¨® que algo m¨¢s deb¨ªa estar pasando. Una nueva serie de consultas m¨¦dicas la condujo, finalmente, al diagn¨®stico correcto: unas prote¨ªnas con malformaciones se acumulaban en su torrente sangu¨ªneo y en sus ¨®rganos. Esos grandes pegotes de prote¨ªna se llaman amiloide y el diagn¨®stico de su enfermedad fue amiloidosis.
Las enfermedades amiloides que afectan al cerebro, como el alzh¨¦imer?y el p¨¢rkinson, reciben la mayor parte de la atenci¨®n de los m¨¦dicos y la prensa. En contraste, las enfermedades amiloides que afectan a otras partes del cuerpo son trastornos menos conocidos y rara vez diagnosticados, dice Gareth Morgan, bioqu¨ªmico de la Facultad de Medicina Chobanian & Avedisian de la Universidad de Boston. Los m¨¦dicos pueden tener dificultades para reconocerlos y distinguirlos, especialmente en las primeras etapas.
Las opciones de tratamiento tambi¨¦n son limitadas. Lousada, ahora directora ejecutiva del?Consorcio para la Investigaci¨®n en Amiloidosis, una organizaci¨®n sin fines de lucro con sede en Newton, Massachusetts, tuvo la suerte de sobrevivir gracias a un trasplante de c¨¦lulas madre que es demasiado agotador o inadecuado para muchas personas con amiloidosis.
Han aparecido varios medicamentos nuevos en los ¨²ltimos cinco a?os (y, en opini¨®n de Lousada, ¡°han sido verdaderos agentes de cambio¡±). Pero, aunque estas terapias pueden bloquear la formaci¨®n de amiloide nuevo y da?ino, no pueden disolver el amiloide que ya se ha acumulado. El cuerpo tiene procesos naturales para hacer eso, pero a menudo son demasiado lentos para eliminar el amiloide acumulado durante a?os, en especial en personas mayores. Y as¨ª, los pacientes siguen sufriendo por el amiloide que obstruye sus ¨®rganos y las personas siguen muriendo de amiloidosis, incluso aunque sobrevivan m¨¢s tiempo que antes.
Los cient¨ªficos est¨¢n trabajando en tratamientos m¨¢s nuevos, incluidos algunos que pueden ayudar a las propias c¨¦lulas inmunitarias del paciente a atacar y destruir el amiloide residual.
Cuando el plegado sale mal
Las estructuras amiloides son prote¨ªnas naturales del organismo que se desarrollaron terriblemente mal. Cuando la formaci¨®n de prote¨ªnas ocurre con normalidad, las cadenas de amino¨¢cidos se curvan y se pliegan, como un origami preciso, para crear sus formas funcionales finales. Pero a veces, debido a errores gen¨¦ticos o al envejecimiento, una prote¨ªna adopta una forma alternativa e inapropiada que deja expuestos fragmentos que son pegajosos. Las prote¨ªnas mal plegadas comienzan a agruparse en peque?os grumos, luego en cadenas m¨¢s grandes llamadas fibrillas y finalmente en enormes estructuras rectangulares llamadas amiloides. El amiloide puede entorpecer el funcionamiento de las c¨¦lulas simplemente interfiriendo en su trabajo, pero tambi¨¦n puede interactuar con otras mol¨¦culas para producir efectos t¨®xicos directos.
Hay unas pocas docenas de prote¨ªnas humanas que tienen propensi¨®n a formar amiloide, y los cient¨ªficos regularmente agregan alguna m¨¢s a la lista, dice Fabrizio Chiti, bioqu¨ªmico de la Universidad de Florencia, Italia, coautor de un art¨ªculo sobre?prote¨ªnas mal plegadas en enfermedades?para el?Annual Review of Biochemistry. El cuerpo tiene formas de identificar y eliminar estas prote¨ªnas mal plegadas, pero con la edad, estas defensas tienden a fallar, por lo que las enfermedades amiloides suelen afectar a las personas mayores.
Una de las enfermedades amiloides m¨¢s comunes que no afectan el cerebro es la amiloidosis por transtiretina, o ATTR; ocurre cuando una prote¨ªna llamada transtiretina se pliega mal. El trabajo normal de la transtiretina es transportar una hormona tiroidea y vitamina A en la sangre hacia diferentes partes del cuerpo. Cuando forma amiloide, el resultado es diferente dependiendo de d¨®nde se depositen las prote¨ªnas malformadas. En los nervios perif¨¦ricos, el amiloide provoca s¨ªntomas como hormigueo y entumecimiento en las extremidades. M¨¢s com¨²nmente, el amiloide se forma en el coraz¨®n, donde causa s¨ªntomas de miocardiopat¨ªa, como ritmo card¨ªaco anormal y dificultad para?respirar.
Cada a?o se diagnostican?unos 7.000 nuevos casos de miocardiopat¨ªa ATTR en Estados Unidos, pero m¨¢s personas pueden tener algo de este amiloide en el coraz¨®n sin manifestar s¨ªntomas, dice Morgan. La miocardiopat¨ªa ATTR puede ser responsable de muchos m¨¢s casos de enfermedad card¨ªaca de lo que los m¨¦dicos creen.

El amiloide puede formarse a partir de transtiretina completamente normal, pero otra forma hereditaria de la enfermedad ocurre cuando una mutaci¨®n gen¨¦tica hace que la prote¨ªna transtiretina sea particularmente propensa a plegarse de manera incorrecta. Esa forma de la enfermedad es la que los m¨¦dicos sospecharon para el caso de Lousada, al menos despu¨¦s de la boda. La ATTR hereditaria puede ocurrir en personas de ascendencia portuguesa, y un m¨¦dico not¨® que el apellido de Lousada era de ese pa¨ªs.
Los m¨¦dicos realizaron una biopsia de h¨ªgado y usaron una tinci¨®n especial para identificar el amiloide, pero los estudios indicaron que la ATTR no era la respuesta. Result¨® que los ri?ones, el h¨ªgado, el bazo y el coraz¨®n de Lousada estaban repletos de otro tipo de amiloide formado a partir de una porci¨®n de prote¨ªna de un anticuerpo.
Nuestros cuerpos producen una gran diversidad de anticuerpos para ayudarnos a defendernos contra innumerables amenazas externas. Pero a veces, una c¨¦lula inmunitaria comienza a copiarse a s¨ª misma sin control, generando toneladas de un solo tipo de anticuerpo. Tal vez el 1% de las personas mayores de 50 a?os tienen esta afecci¨®n sin ning¨²n problema, dice Morgan. Pero si esas c¨¦lulas inmunitarias acumulan defectos adicionales pueden apoderarse de la m¨¦dula ¨®sea y convertirse en un tipo de c¨¢ncer de la sangre llamado mieloma m¨²ltiple. O si los anticuerpos producidos en exceso incluyen segmentos mal plegados en una parte del anticuerpo llamada cadena ligera, el resultado es amiloidosis de cadena ligera, o AL.
La amiloidosis AL causa una variedad de s¨ªntomas, que incluyen, com¨²nmente, da?o renal o card¨ªaco. En etapas avanzadas, la lengua puede hincharse con amiloide y los vasos sangu¨ªneos alrededor de los ojos pueden da?arse. ¡°Es casi como tener los ojos morados todo el tiempo¡±, dice Morgan. Aunque la AL es la otra forma m¨¢s com¨²n de amiloidosis no cerebral, solo se diagnostican?unos 3.200 casos?al a?o en Estados Unidos.
El diagn¨®stico de AL de Lousada se hizo hace d¨¦cadas y tuvo suerte: finalmente, una terapia funcion¨®, pero no de inmediato. Los m¨¦dicos primero probaron con quimioterapia, pero su enfermedad sigui¨® empeorando, y en Londres los especialistas le dieron de alta envi¨¢ndola a cuidados paliativos, pues estimaban que le quedaban meses de vida.
De nuevo, su cu?ado vino al rescate y la conect¨® con un hospital en Boston que estaba haciendo trasplantes de c¨¦lulas madre (un tratamiento para mieloma m¨²ltiple) en pacientes con AL. La idea era eliminar la m¨¦dula ¨®sea de la que surgen las c¨¦lulas inmunitarias y luego reemplazarla con una nueva m¨¦dula de un donante. Esto deber¨ªa eliminar las c¨¦lulas que generaban la prote¨ªna de cadena ligera problem¨¢tica.
Lousada se someti¨® al tratamiento, que requiri¨® meses en el hospital, y tard¨® a?os en recuperarse por completo.
Como en el caso de AL, las opciones de tratamiento para ATTR tambi¨¦n eran limitadas y dif¨ªciles en el pasado. La mayor parte de la transtiretina se produce en el h¨ªgado, por lo que un trasplante de h¨ªgado puede ayudar a algunas personas que padecen la forma hereditaria. Pero eso hace que los pacientes deban tomar inmunosupresores de por vida, para que no rechacen el nuevo h¨ªgado.
Se necesitaban desesperadamente m¨¢s opciones y a?os atr¨¢s, mucho antes de que Lousada se enfermara, los investigadores estaban trabajando en el problema.
Una variedad de enfoques farmacol¨®gicos
Desde 1989, el neurobi¨®logo qu¨ªmico Jeffery Kelly se hab¨ªa propuesto desarrollar medicamentos para la ATTR. Kelly, que ahora trabaja en el Instituto Scripps Research en La Jolla, California, sab¨ªa que la transtiretina normal consta de cuatro prote¨ªnas individuales unidas y que, en esa forma, no puede plegarse mal ni generar amiloide. Entonces pens¨® que si pod¨ªa usar una mol¨¦cula peque?a para?fijar a las cuatro mol¨¦culas de transtiretina?en la forma adecuada podr¨ªa evitar que adquiriera una forma nueva y da?ina.
En varios estudios y por m¨¢s de una d¨¦cada, el equipo de Kelly prob¨®?alrededor de 1.000 mol¨¦culas potenciales?en tubos de ensayo para determinar la capacidad de estabilizar la transtiretina. Cuando se forma amiloide, las soluciones contenidas en los tubos se vuelvan turbias u opacas bajo la luz violeta y luz ultravioleta cercana, de modo que los cient¨ªficos pod¨ªan medir cu¨¢ndo los medicamentos inhib¨ªan la creaci¨®n de amiloide. Despu¨¦s de hacer modificaciones qu¨ªmicas en los f¨¢rmacos candidatos se?decidieron por una mol¨¦cula?llamada tafamidis.
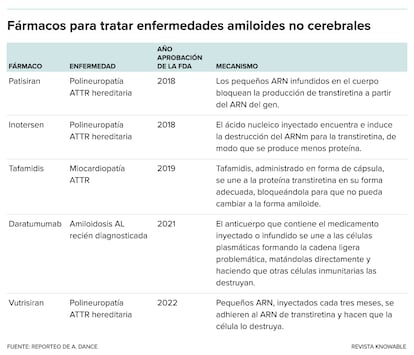
Kelly cofund¨® la empresa FoldRx para desarrollar el f¨¢rmaco, y Pfizer adquiri¨® FoldRx en 2010. En un ensayo internacional, los investigadores estudiaron a 128 personas que ten¨ªan polineuropat¨ªa debido a la mutaci¨®n de la transtiretina, la misma que los m¨¦dicos alguna vez sospecharon para el caso de Lousada. El medicamento?disminuy¨® la velocidad a la que empeoraron sus s¨ªntomas. Este estudio, que se centr¨® en personas con neuropat¨ªa y se public¨® en 2012, llev¨® a la aprobaci¨®n de tafamidis en varios pa¨ªses. Un segundo ensayo en 441 pacientes que ten¨ªan una enfermedad card¨ªaca causada por ATTR mostr¨® que el f¨¢rmaco?redujo las hospitalizaciones y muertes relacionadas con problemas cardiovasculares?y?enlenteci¨® la p¨¦rdida de calidad de vida, lo que llev¨® a que la Administraci¨®n de Alimentos y Medicamentos de EE.UU. (FDA) aprobara el f¨¢rmaco para la?miocardiopat¨ªa ATTR?en 2019.
En la actualidad, dice Kelly, hay unas 30.000 personas que toman tafamidis en el mundo, pero cree que muchas m¨¢s podr¨ªan beneficiarse si fuera m¨¢s f¨¢cil diagnosticar la ATTR.
Otros investigadores est¨¢n desarrollando medicamentos utilizando diferentes enfoques. Por ejemplo, mientras que el tafamidis estabiliza la transtiretina, otros cient¨ªficos han decidido eliminar la prote¨ªna en s¨ª. Eso es posible porque hay otras prote¨ªnas que pueden hacer el trabajo de transporte que hace la transtiretina, dice el m¨¦dico David Lebwohl, director m¨¦dico de Intellia Therapeutics en Cambridge, Massachusetts. La compa?¨ªa est¨¢ utilizando una forma de terapia g¨¦nica para desactivar el gen de la transtiretina en el h¨ªgado de pacientes con ATTR.
En un ensayo inicial con 15 personas con polineuropat¨ªa ATTR hereditaria, el tratamiento fue seguro y redujo la cantidad de transtiretina presente en la sangre en un promedio de 93% en la dosis m¨¢s alta. Intellia espera comenzar un ensayo m¨¢s amplio que analice el f¨¢rmaco en pacientes con miocardiopat¨ªa ATTR para finales de 2023. Si tiene ¨¦xito, esta terapia de Intellia podr¨ªa unirse a otros tres tratamientos gen¨¦ticos antitranstiretina que han aparecido en los ¨²ltimos cinco a?os: inotersen, patisiran y vutrisiran. Estos medicamentos usan peque?os fragmentos de ¨¢cido nucleico que bloquean la producci¨®n de transtiretina, sin desactivar el gen como lo hace la estrategia de Intellia.
Las cosas tambi¨¦n est¨¢n mejorando para los tratamientos contra la amiloidosis AL. En 2021, la FDA aprob¨® una terapia que conten¨ªa daratumumab, otro f¨¢rmaco contra el mieloma m¨²ltiple, para usar espec¨ªficamente contra la AL. Al igual que la mol¨¦cula detr¨¢s de la enfermedad, este tratamiento es un anticuerpo, pero uno completamente diferente. El anticuerpo daratumumab se adhiere a las c¨¦lulas inmunitarias problem¨¢ticas que est¨¢n produciendo cadenas ligeras. Act¨²a como una etiqueta que alerta a otros elementos del sistema inmunitario para que destruyan las c¨¦lulas problem¨¢ticas. Una vez que se han ido, ya no pueden diseminar el anticuerpo AL problem¨¢tico.
Y Kelly, inspirado por su anterior ¨¦xito en la estabilizaci¨®n de prote¨ªnas, espera aplicar la estrategia de tafamidis a la AL. Junto a Morgan, que sol¨ªa trabajar en su laboratorio, est¨¢n a la caza de peque?as mol¨¦culas que?fijen la cadena ligera del anticuerpo?en su forma adecuada para que no pueda plegarse mal. Esto es m¨¢s desafiante que para la transtiretina, dice Morgan, porque cada persona con AL tiene una cadena ligera diferente detr¨¢s de su enfermedad. Necesitan una mol¨¦cula que las estabilice a todas y cada una de ellas.
Despu¨¦s de examinar m¨¢s de 650.000 mol¨¦culas peque?as, Morgan y Kelly encontraron varios candidatos. Basados en pruebas bioqu¨ªmicas y estudios de estructuras moleculares, piensan que estas drogas potenciales pueden deslizarse en el espacio entre cualquier par de cadenas ligeras y mantenerlas en su forma adecuada. El equipo ha hecho ajustes qu¨ªmicos para crear mol¨¦culas que hagan esto a¨²n mejor. El siguiente paso ser¨¢ probar estos f¨¢rmacos candidatos en muestras de sangre de pacientes en el laboratorio de Morgan, para ver si pueden estabilizar las prote¨ªnas de cadena ligera de personas que se sabe que tienen AL. Kelly cofund¨® otra empresa, Protego, para llevar este medicamento al mercado (Kelly tambi¨¦n forma parte del consejo asesor cient¨ªfico del Consorcio de Investigaci¨®n de Amiloidosis).
Atacando directamente al amiloide
Aunque estos nuevos medicamentos detienen la formaci¨®n de amiloide es dif¨ªcil decir cu¨¢nto ayudan con el amiloide que ya est¨¢ presente en los pacientes, lo que puede hacer que persistan los s¨ªntomas.
Los cient¨ªficos sospechan que, con el tiempo, el sistema inmunitario ¡ªal menos en las personas m¨¢s j¨®venes¡ª pueda identificar y eliminar esta basura residual de prote¨ªnas. Pero algunos investigadores est¨¢n trabajando en encontrar formas de facilitar la eliminaci¨®n directa de amiloide, como desarrollar anticuerpos que lleven a las c¨¦lulas inmunitarias a tomar una forma espec¨ªfica de amiloide, o incluso a cualquier forma de amiloide. Esos anticuerpos pan-amiloides, en teor¨ªa, beneficiar¨ªan no solo a los pacientes con ATTR o AL, sino tambi¨¦n a quienes padezcan otras enfermedades amiloides. Ya existe un nuevo f¨¢rmaco de anticuerpos para el alzh¨¦imer, llamado?lecanemab, que identifica el amiloide asociado con esa enfermedad y parece reducir su cantidad.
Y Kelly, quien es coautor de un art¨ªculo sobre?enfermedades del mantenimiento de prote¨ªnas?en el?Annual Review of Biochemistry, est¨¢ interesado en acelerar un proceso natural llamado autofagia. Este proceso es usado por las c¨¦lulas del cuerpo cuando presentan algo que es peligroso, est¨¢ da?ado o simplemente ya no es ¨²til. As¨ª, desv¨ªan la basura a una bolsa ¨¢cida llamada?lisosoma, donde se destruye.
Las c¨¦lulas inmunitarias, por ejemplo, usan la autofagia para destruir la basura que recogen, que es probablemente la forma en que los j¨®venes con sistemas inmunitarios activos pueden deshacerse del amiloide residual. Pero Kelly sospecha que algunos de estos mecanismos de autofagia quedan inactivos en las personas mayores y los defectos en la autofagia se han?vinculado a enfermedades neurol¨®gicas amiloides.
Kelly espera que aumentar la autofagia en personas mayores con amiloidosis permitir¨¢ que sus c¨¦lulas inmunitarias envejecidas eliminen la basura adecuadamente. Presume que esto funcionar¨ªa en cualquier forma de amiloide, en el cerebro y en el resto del cuerpo.
Para encontrar mol¨¦culas que promuevan la autofagia, el equipo empez¨® probando 940.000 mol¨¦culas peque?as para identificar aquellas que pudieran promover la destrucci¨®n de las gotas de grasa, que son objetivos naturales de la autofagia, y tambi¨¦n otros m¨¦todos de degradaci¨®n, en c¨¦lulas que crecen en placas de laboratorio. Luego tomaron los que tuvieron mejores resultados y los probaron espec¨ªficamente para la activaci¨®n de la autofagia, y para medir la autofagia exitosa, utilizaron la desaparici¨®n de un trozo de prote¨ªna verde brillante a medida que se diger¨ªa.
Como se dio a conocer en un art¨ªculo publicado como preimpresi¨®n, un f¨¢rmaco candidato prometedor?redujo la cantidad de amiloide en c¨¦lulas cultivadas en el laboratorio que produjeron uno de los dos amiloides bien conocidos: el amiloide de prote¨ªna tau, relacionado con la?enfermedad de Alzheimer, o una prote¨ªna amiloide?asociada a lo que se conoce como enfermedad de la vaca loca. Los investigadores a¨²n necesitan comprender el mecanismo del f¨¢rmaco, por ahora llamado CCT020312, antes de comenzar los ensayos cl¨ªnicos.
El estudio de la amiloidosis ha recorrido un largo camino en las ¨²ltimas tres d¨¦cadas. ¡°Es un momento realmente incre¨ªble para estar en este campo, porque han sucedido muchas cosas¡±, dice Morgan. El experto avizora un d¨ªa en que los tratamientos combinar¨¢n varios enfoques: detener la producci¨®n de la prote¨ªna problem¨¢tica, como hacen el daratumumab y la terapia g¨¦nica; estabilizar la prote¨ªna que todav¨ªa se produce, como lo hace tafamidis; y limpiar el amiloide residual, como pretenden hacer los enfoques del sistema inmunitario.
Con el tiempo, quiz¨¢s, m¨¢s personas con amiloidosis tendr¨¢n resultados sorprendentes como los que tuvo Lousada, pero con tratamientos mucho menos onerosos que un trasplante. Veintisiete a?os despu¨¦s de su diagn¨®stico, Lousada est¨¢ completamente recuperada, aunque todav¨ªa se somete a an¨¢lisis de sangre regulares para verificar si la cadena ligera se est¨¢ acumulando nuevamente en su cuerpo. Junto a su esposo tienen tres hijos, se mudaron a Estados Unidos y ella se ha convertido en activista de la investigaci¨®n de la amiloidosis. ¡°Cuando sal¨ª de esta experiencia, realmente sent¨ª que podr¨ªa hacer algo que tuviera m¨¢s significado e impacto que la arquitectura¡±, dice. ¡°En todos los sentidos, cambi¨® la trayectoria de mi vida¡±.
Art¨ªculo traducido por Debbie Ponchner
Este art¨ªculo apareci¨® originalmente en Knowable en espa?ol, una publicaci¨®n sin ¨¢nimo de lucro dedicada a poner el conocimiento cient¨ªfico al alcance de todos.
Puedes seguir a EL PA?S Salud y Bienestar en Facebook, Twitter e Instagram.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.

































































