Los ribosomas, mĻĒquinas de hacer vida
Las factorĻŠas de proteĻŠnas, cuyo estudio ha merecido el Nobel de QuĻŠmica, son diferentes en humanos y bacterias y en eso se basa la acciĻŪn de varios antibiĻŪticos
Los ribosomas, encargados de ensamblar uno a uno los aminoĻĒcidos que componen cada proteĻŠna, son los operarios mĻĒs complejos en el proceso de mantener la vida de las cĻĶlulas. Vivimos gracias a que la informaciĻŪn heredada de nuestros padres, contenida en el ADN, se convierte en molĻĶculas, todas las que forman nuestras cĻĶlulas y las hacen funcionar. La informaciĻŪn del ADN estĻĒ escrita en un lenguaje que solo entienden varias estructuras -ribosomas, polimerasas, ARNs- que en cada cĻĶlula se dedican a copiar, transcribir y traducir lo que allĻŠ se dice para convertirlo en todo el contenido celular, en cĻĶlula viva.
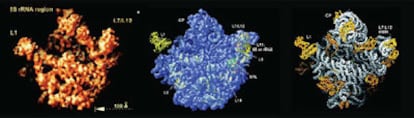
La estructura de los ribosomas no fue fĻĒcil de determinar, estĻĒn compuestos por demasiadas piezas (de proteĻŠna y de ĻĒcido ribonucleico) y, aunque de tama?o submicroscĻŪpico, son demasiado grandes para que las tĻĶcnicas usadas para averiguar la estructura del ADN los pudieran cartografiar. Tras disponer de muchos datos y avances tĻĶcnicos, los equipos de Ramakrishnan, Steitz y Yonath determinaron en el a?o 2000 cĻŪmo las distintas piezas encajan en el gran rompecabezas.
El trabajo que Ada E. Yonath iniciĻŪ hacia 1980 fue crucial para conseguir cristales de ribosomas bacterianos con la calidad necesaria para que se obtuvieran buenos datos con las tĻĶcnicas de difracciĻŪn de rayos X capaces de revelar el lugar que los ĻĒtomos ocupan en una estructura. Fue dieciocho a?os despuĻĶs cuando el grupo de Thomas A. Steitz obtuvo alguna pista sobre la estructura reconstruyendo la apariencia tridimensional a baja resoluciĻŪn de una de las dos subunidades que forman cada ribosoma a partir de imĻĒgenes de subunidades congeladas obtenidas al microscopio electrĻŪnico. La imagen aproximada de la otra subunidad la obtuvo el grupo de Venkatraman Ramakrishnan, tambiĻĶn en 1998. Al avance tambiĻĶn contribuyĻŪ la utilizaciĻŪn del sincrotrĻŪn como una mejor fuente de radiaciĻŪn y datos genĻĶticos que permitieron obtener algunas variantes de ribosomas que eran mĻĒs fĻĒciles de observar. Estos resultados iniciales permitieron avanzar con mayor rapidez, y solo pasaron tres a?os mĻĒs para que entre los tres grupos tuvieran una imagen de alta resoluciĻŪn del ribosoma completo.
Una de las sorpresas que se descubriĻŪ al ver la estructura del sitio donde se produce el engarce de un aminoĻĒcido con otro es que no es un receptĻĒculo de proteĻŠna, sino que lo que mĻĒs hay allĻŠ es ARN, el otro componente de los ribosomas. La observaciĻŪn inicial se interpretĻŪ como que el ribosoma es una ribozima (un ARN catalĻŠtico), y que posiblemente se conservĻŪ asĻŠ desde el momento en el que la vida se iniciase en un mundo de RNA, en el que este tipo de molĻĶcula, no solo llevaba la informaciĻŪn del ADN de un lado a otro, sino que tenĻŠa un importante papel funcional. Pero los resultados posteriores han aclarado que la actividad del ribosoma deriva de un terceto: uno de sus RNAs, una de sus proteĻŠnas, y otro RNA al que va unido cada aminoĻĒcido y que se va quedando en el sitio del ribosoma que ocupa la proteĻŠna naciente segĻēn crece. CĻŪmo se originĻŪ la vida parece pues algo mĻĒs complejo de lo que en principio parecĻŠa.
Todas las cĻĶlulas utilizan ribosomas para producir proteĻŠnas, pero nuestros ribosomas son diferentes de los de las bacterias, para empezar son de mĻĒs tama?o. En esas diferencias se basa la acciĻŪn de varios antibiĻŪticos, la estreptomicina entre los mĻĒs antiguos y el linezolid entre los mĻĒs nuevos, que bloquean la sĻŠntesis de proteĻŠnas en las bacterias y las matan, mientras que no perjudican a nuestro cuerpo. El 50% de los antibiĻŪticos actĻēa sobre los ribosomas. Conocer su estructura a nivel atĻŪmico enseguida permitiĻŪ determinar muchos detalles sobre cĻŪmo funcionan varios antibiĻŪticos y tambiĻĶn sentar las bases para en el futuro encontrar otros nuevos, algo cada vez mĻĒs necesario para tratar a las bacterias que, frente al gran uso y muchas veces el abuso o mal uso de estas medicinas, se han hecho resistentes a los tratamientos mĻĒs comunes.
Miguel Vicente es profesor de InvestigaciĻŪn en el Centro Nacional de BiotecnologĻŠa - CSIC
Tu suscripciĻŪn se estĻĒ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripciĻŪn?
Si continĻēas leyendo en este dispositivo, no se podrĻĒ leer en el otro.
FlechaTu suscripciĻŪn se estĻĒ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripciĻŪn a la modalidad Premium, asĻŠ podrĻĒs a?adir otro usuario. Cada uno accederĻĒ con su propia cuenta de email, lo que os permitirĻĒ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripciĻŪn de empresa? Accede aquĻŠ para contratar mĻĒs cuentas.
En el caso de no saber quiĻĶn estĻĒ usando tu cuenta, te recomendamos cambiar tu contrase?a aquĻŠ.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrarĻĒ en tu dispositivo y en el de la otra persona que estĻĒ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquĻŠ los tĻĶrminos y condiciones de la suscripciĻŪn digital.
































































