El taller est¨¢ dentro del cuerpo
El CNIO logra generar por primera vez c¨¦lulas madre embrionarias en un rat¨®n vivo Son de una extraordinaria versatilidad La t¨¦cnica apunta a la reparaci¨®n interna de ¨®rganos
Desde que en 2006 se consigui¨® reprogramar simples c¨¦lulas adultas de la piel para transformarlas en c¨¦lulas madre iPS, tan vers¨¢tiles como las c¨¦lulas madre embrionarias, este procedimiento siempre se hab¨ªa realizado en el laboratorio. Un equipo del Centro Nacional de Investigaciones Oncol¨®gicas (CNIO) ha demostrado, por vez primera, que el proceso de retrasar el reloj de las c¨¦lulas adultas (reprogramarlas) para convertirlas en iPS se puede provocar tambi¨¦n en el organismo de un ser vivo adulto, en este caso un rat¨®n. El trabajo, que publica Nature, presenta otros dos aspectos de una extraordinaria relevancia. Por un lado, estas c¨¦lulas madre obtenidas en ratones tienen mayor capacidad de diferenciaci¨®n (de convertirse en distintos tejidos) que las obtenidas en el laboratorio. Por otro, aunque esta nueva t¨¦cnica no tiene impacto terap¨¦utico directo, permite pensar, cara a un futuro a¨²n lejano, en un ilusionante objetivo: que sean los propios ¨®rganos lesionados los que puedan producir c¨¦lulas madre para regenerarse.
¡°Es un trabajo excepcional¡±, reflexiona Juan Carlos Izpis¨²a, director del Centro de Medicina Regenerativa de Barcelona (CMRB) e investigador y profesor del Instituto Salk de California. ¡°Abre una nueva etapa para la medicina, la b¨²squeda de estrategias que nos permitan regenerar ¨®rganos y tejidos de una forma similar a los procesos naturales¡±.
El art¨ªculo, llamado a hacerse un importante hueco en el extraordinariamente competitivo mundo de la investigaci¨®n con c¨¦lulas madre, no pod¨ªa haber llegado en un momento m¨¢s oportuno. No solo porque sirve para reivindicar el trabajo de un prestigioso centro de investigaci¨®n como es el CNIO, que en los ¨²ltimos meses ha debido m¨¢s su presencia en los medios a las dificultades econ¨®micas por las que atraviesa. Sino porque sirve para revalorizar el trabajo de los cient¨ªficos espa?oles en un entorno de reducci¨®n sin precedentes de la inversi¨®n p¨²blica en I+D+i, de despidos, impagos y huida al extranjero de las generaciones m¨¢s j¨®venes ante la falta de expectativas en Espa?a.
El trabajo del grupo de Manuel Serrano, director del programa de Oncolog¨ªa Molecular del CNIO, parte de la t¨¦cnica que le permiti¨® al investigador japon¨¦s Shinya Yamanaka obtener c¨¦lulas madre iPS en 2006 y el Nobel en 2012.
Yamanaka reprogram¨® las c¨¦lulas adultas introduciendo en ellas cuatro genes caracter¨ªsticos de la etapa embrionaria, de forma que, al activarse, devuelven a la c¨¦lula a un estadio pr¨¢cticamente igual al de una embrionaria, convirti¨¦ndola en la famosa iPS (induced pluripotent stem cells o c¨¦lulas de pluripotencia inducida). Serrano ha usado la misma combinaci¨®n de genes, el llamado c¨®ctel Yamanaka, pero le ha dado varias vueltas de tuerca, con unos resultados sorprendentes e inesperados.
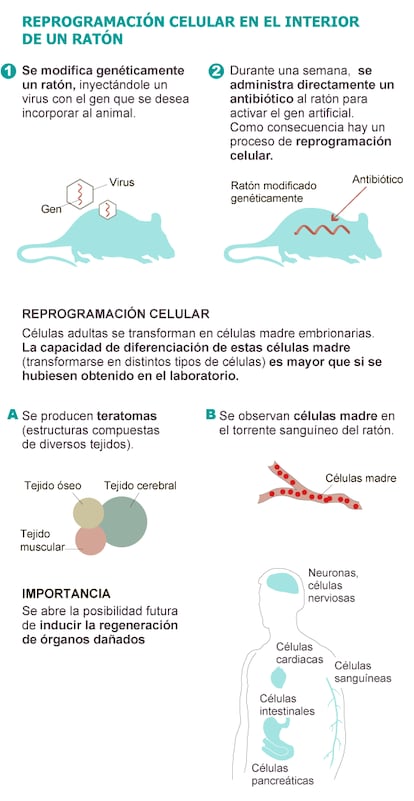
El equipo del investigador espa?ol dise?¨® un rat¨®n al que introdujo un gen artificial que, en respuesta a la administraci¨®n de un antibi¨®tico ¡ªtetraciclina¡ª se activa y produce el mismo efecto que el c¨®ctel de las cuatro prote¨ªnas de Yamanaka.
Hitos de las c¨¦lulas madre embrionarias

1. Noviembre de 1998. James Thomson, de la Universidad de Wisconsisn aisla por primera vez las c¨¦lulas embrionarias humanas. El trabajo mostr¨® que si se cultivaban, eran capaces de reproducirse indefinidamente en el laboratorio y, en ciertas condiciones, convertirse en cualquiera de los cientos de tejidos distintos que forman el cuerpo humano.
2. Agosto de 2006. Cient¨ªficos estadounidenses consiguen obtener c¨¦lulas madre embrionarias sin la necesidad de destruir los embriones para obtenerlas ante la negativa del Gobierno estadounidense de destinar fondos p¨²blicos para experimetar con este material biol¨®gico.
3. Noviembre de 2007. El profesor de la Universidad de Tokio Shinya Yamanaka demuestra que es posible transformar en el laboratorio c¨¦lulas adultas de rat¨®n en c¨¦lulas madre con caracter¨ªsticas embrionarias, las llamadas iPS o c¨¦lulas de pluripotencia inducida. Un a?o m¨¢s tarde lo consigui¨® tambi¨¦n con c¨¦lulas humanas. En 2012 obtuvo el premio Nobel por la importancia de estos trabajos.
4. Septiembre de 2010. El hospital Northwestern Medicine, en Chicago, es el primero en dise?ar un ensayo cl¨ªnico con c¨¦lulas madre embrionarias humanas. La terapia se aplica a una persona con una lesi¨®n medular.
5. Mayo de 2013. Un grupo de cient¨ªficos estadounidenses consigue crear c¨¦lulas madre embrionarias clonadas a partir del ADN de un adulto. De ellas se podr¨ªan desarrollar cultivos y diferenciarlos en distintos tipos de tejidos.
6. Junio de 2013. Las autoridades sanitarias japonesas autorizan el primer ensayo cl¨ªnico del mundo con c¨¦lulas madre iPS (de pluripotencia inducida). Los cient¨ªficos pretenden crear con ellas retinas para implantarlas en personas ciegas con degeneraci¨®n macular.
7. Julio de 2013. Investigadores japoneses crean minih¨ªgados vascularizados a partir de c¨¦lulas iPS.
8. Julio de 2013. Un grupo austriaco desarrolla microcerebros humanos de cuatro mil¨ªmetros con c¨¦lulas madre de pluripotencia inducida.
La intenci¨®n original de Serrano no era generar c¨¦lulas madre iPS en el interior de los roedores, sino algo ¡°mucho m¨¢s prosaico¡±, como traslada a este diario. Buscaba una forma sencilla de obtener c¨¦lulas madre embrionarias. Y la forma de conseguirlas era extraer las c¨¦lulas de los ratones con el genoma modificado, ba?arlas en una placa de laboratorio con el antibi¨®tico y generar f¨¢cilmente cultivos de c¨¦lulas iPS.
Pero en un momento dado, le surgi¨® la duda. ?Qu¨¦ suceder¨ªa si se administraba el antibi¨®tico directamente al rat¨®n modificado gen¨¦ticamente y no a los cultivos de sus c¨¦lulas? ¡°Sinceramente, no confi¨¢bamos en que las c¨¦lulas se fueran a reprogramar dentro del rat¨®n¡±, traslada el investigador. ¡°No cre¨ªamos que funcionara¡±, insiste. Pero funcion¨®.
Los ratones modificados de Serrano bebieron el antibi¨®tico diluido en agua durante una semana. Al poner en marcha el mecanismo descrito por Yamanaka y adaptado por el CNIO, los investigadores observaron que c¨¦lulas adultas de los ratones perd¨ªan sus caracter¨ªsticas y adquir¨ªan rasgos de c¨¦lulas embrionarias ¡°que no existen en los organismos adultos¡±, destaca Serrano. Las c¨¦lulas adultas retroced¨ªan en su desarrollo evolutivo hasta convertirse en c¨¦lulas madre embrionarias en m¨²ltiples tejidos y ¨®rganos.
Este cambio de direcci¨®n, como subraya Mar¨ªa Abad, la primera firmante del art¨ªculo, ¡°nunca se ha observado en la naturaleza¡±. Y a?ade: ¡°Hemos demostrado que podemos obtener c¨¦lulas madre embrionarias tambi¨¦n en organismos adultos, y no solo en el laboratorio¡±.
Tras desprogramarse y transformarse en c¨¦lulas madre, las c¨¦lulas se replicaban de forma descontrolada y desordenada en el interior del cuerpo de los roedores dando lugar a una especie de masa compuesta de diferentes tejidos (cerebral, muscular, ¨®seo, intestinal...). Una especie de embri¨®n desorganizado denominado teratoma.
La importancia de estas estructuras pseudoembrionarias que aparec¨ªan por decenas en el t¨®rax y en el abdomen no est¨¢ en su utilidad cl¨ªnica. Ninguna terapia puede pasar por provocar teratomas. Lo relevante es que de esta forma quedaba patente la elevada capacidad de diferenciaci¨®n de las c¨¦lulas madre generadas en el interior de los ratones. Estas estructuras no solo conten¨ªan c¨¦lulas derivadas del desarrollo del embri¨®n (de las tres capas que lo conforman), sino incluso de tejidos externos al embri¨®n, como es el caso del saco vitelino.
Adem¨¢s, los investigadores del CNIO detectaron c¨¦lulas madre en el torrente sangu¨ªneo de los ratones tratados.
En ambos casos ¡ªtanto en los teratomas como en la sangre¡ª las c¨¦lulas madre obtenidas presentaban unos estadios embrionarios a¨²n m¨¢s tempranos que las c¨¦lulas producidas mediante la t¨¦cnica de Yamanaka. Es decir, hab¨ªan retrocedido a un nivel m¨¢s primitivo, por lo que presentaban una mayor facultad de diferenciaci¨®n en distintos tipos celulares. Contaban con caracter¨ªsticas de embriones humanos de tan solo 72 horas de gestaci¨®n y 16 c¨¦lulas, que en la jerga se denominan rasgos totipotentes.
Estas caracter¨ªsticas de indiferenciaci¨®n tan elevadas ¡°nunca se hab¨ªan generado en el laboratorio¡±, seg¨²n los autores. ¡°Estos datos nos indican que nuestras c¨¦lulas madre son mucho m¨¢s vers¨¢tiles que las c¨¦lulas iPS de Yamanaka¡±, insiste Serrano. La contrapartida de esta facultad es que las c¨¦lulas son m¨¢s dif¨ªciles de controlar cuando llega el momento de convertirlas en tejidos concretos. El objetivo de la medicina regenerativa consiste en curar ¨®rganos da?ados a trav¨¦s de c¨¦lulas sanas. La materia prima de este enfoque terap¨¦utico son las c¨¦lulas madre, por su capacidad de convertirse en cualquiera de los m¨¢s de 100 tipos celulares. Los especialistas aspiran a poder manipular estas c¨¦lulas desprogramadas para convertirlas en c¨¦lulas sanas de h¨ªgado, coraz¨®n o p¨¢ncreas con las que tratar insuficiencias hep¨¢ticas, infartos o diabetes. O incluso desarrollar en el laboratorio ¨®rganos completos de repuesto para sustituir a los enfermos. En ambos casos, la condici¨®n inicial es que existan c¨¦lulas madre de f¨¢cil acceso y gran capacidad de diferenciaci¨®n.
Las c¨¦lulas iPS cumplen, en general, estas condiciones de versatilidad. Y, adem¨¢s, no plantean los problemas ¨¦ticos que s¨ª presentan las c¨¦lulas madre embrionarias humanas.
El fin ¨²ltimo es lograr c¨¦lulas sanas de h¨ªgado o coraz¨®n para tratar insuficiencias
Por ello, los investigadores del CNIO plantean que la nueva fuente de c¨¦lulas madre que han descrito puede constituir una fuente alternativa a las que se obtienen en el laboratorio para la investigaci¨®n en medicina regenerativa. ¡°Nuestras c¨¦lulas madre sobreviven tambi¨¦n en cultivos fuera de los ratones¡±, apunta Mar¨ªa Abad.
Pero existe otra futura aplicaci¨®n terap¨¦utica m¨¢s atractiva, aunque su aplicaci¨®n se muestra mucho m¨¢s remota. Se tratar¨ªa de aprovechar la capacidad de crear c¨¦lulas madre dentro del cuerpo para inducir la regeneraci¨®n end¨®gena en un ¨¢rea da?ada.
En los procesos naturales de regeneraci¨®n, las c¨¦lulas sanas dirigen a las c¨¦lulas reparadoras. En el trabajo de los investigadores espa?oles, como explica Serrano, la diferenciaci¨®n inducida en las c¨¦lulas adultas era tan alta que las c¨¦lulas madre eran insensibles a las se?ales del entorno y desarrollaban teratomas.
Uno de los pr¨®ximos objetivos de los investigadores del CNIO consiste en determinar si existe un grado de diferenciaci¨®n que permita a las c¨¦lulas madre interactuar con su entorno y reparar por s¨ª mismas, desde dentro, el tejido lesionado. ¡°Vamos a provocar da?os en ratones, un infarto por ejemplo, y administrar menos medicaci¨®n, de forma que exista un menor grado de reprogramaci¨®n celular¡±, comenta el investigador. ¡°Queremos observar si esas c¨¦lulas menos diferenciadas pueden dar lugar a cardiomiocitos que mejoren la funci¨®n cardiaca¡±.
Este cambio de concepto, el de inducir la regeneraci¨®n terap¨¦utica en lugar de crear tejidos de repuesto en el laboratorio, evitar¨ªa riesgos derivados de las intervenciones quir¨²rgicas a las que se deber¨ªan someter los pacientes para recibir los ¨®rganos y tejidos reparadores. O accidentes en la manipulaci¨®n de los cultivos, entre otros aspectos.
Abad: "Demostramos que podemos obtenerlas en organismos
El grupo de Serrano no es el primero en plantear este enfoque. Un trabajo del Centro de Medicina Regenerativa de Barcelona y el Instituto Salk anunci¨® hace dos meses una nueva f¨®rmula para generar iPS en el laboratorio. En lugar de la receta Yamanaka (que consiste en despertar cuatro genes activos en la etapa embrionaria, dos de los cuales inducen a la formaci¨®n de tumores), este grupo desarroll¨® un c¨®ctel distinto que pasaba por alterar otros siete genes que ya est¨¢n activos en las c¨¦lulas adultas. Ello abr¨ªa la posibilidad de reajustar la expresi¨®n de estos genes dentro del cuerpo para que generaran c¨¦lulas madre reparadoras en los propios tejidos. La misma idea de la regeneraci¨®n end¨®gena de ¨®rganos planteada por Serrano.
Todos estos planteamientos de la medicina regenerativa suenan a¨²n a ciencia ficci¨®n. Y lo son. Aunque cada vez menos. Jap¨®n aprob¨® en junio el primer intento de llevarlos a la pr¨¢ctica. Autoriz¨® un ensayo para crear retinas con c¨¦lulas iPS para implantarlas en ciegos con degeneraci¨®n macular.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripci¨®n de empresa? Accede aqu¨ª para contratar m¨¢s cuentas.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.




























































