La nueva generaci¨®n de f¨¢rmacos radiactivos ataca al c¨¢ncer con precisi¨®n molecular
Los radiof¨¢rmacos buscadores de tumores marcan un nuevo rumbo en oncolog¨ªa y prometen tratamientos espec¨ªficos con menos efectos secundarios
Un mi¨¦rcoles por la ma?ana a finales de enero de 1896, en una peque?a f¨¢brica de bombillas de luz de Chicago, una mujer de mediana edad llamada Rose Lee se encontraba en el centro de un proyecto m¨¦dico innovador. Con un tubo de rayos X colocado sobre el tumor en su seno izquierdo, Lee fue tratada con un torrente de part¨ªculas de alta energ¨ªa que penetraron en la masa maligna. ¡°Y as¨ª¡±, como escribi¨® m¨¢s tarde su m¨¦dico tratante, ¡°sin el sonido de trompetas ni el redoble de tambores, naci¨® la terapia con rayos X¡±.
La radioterapia ha avanzado mucho desde aquellos comienzos tempranos. El descubrimiento del radio y otros metales radiactivos abri¨® las puertas a la administraci¨®n de dosis m¨¢s altas de radiaci¨®n para atacar c¨¢nceres ubicados m¨¢s profundamente en el cuerpo. M¨¢s tarde, la introducci¨®n de la terapia de protones hizo posible guiar con precisi¨®n los haces de radiaci¨®n hacia los tumores, reduciendo as¨ª el da?o a los tejidos sanos circundantes, un grado de precisi¨®n que se perfeccion¨® a¨²n m¨¢s gracias a mejoras en la f¨ªsica m¨¦dica, las tecnolog¨ªas inform¨¢ticas y las t¨¦cnicas de im¨¢genes de ¨²ltima generaci¨®n.
Pero no fue hasta el nuevo milenio, con la llegada de los radiof¨¢rmacos con objetivos espec¨ªficos, que este campo alcanz¨® un nuevo nivel de precisi¨®n molecular. Estos agentes, similares a misiles buscadores de calor programados para cazar el c¨¢ncer, viajan a trav¨¦s del torrente sangu¨ªneo para lanzar sus ojivas radiactivas directamente al sitio del tumor.

En la actualidad, solo un pu?ado de estas terapias est¨¢n disponibles de manera comercial para los pacientes, espec¨ªficamente, para formas de c¨¢ncer de pr¨®stata y para tumores que se originan en las c¨¦lulas productoras de hormonas del p¨¢ncreas y el tracto gastrointestinal. Pero esta cifra est¨¢ por aumentar a medida que los principales actores de la industria biofarmac¨¦utica comiencen a invertir fuertemente en la tecnolog¨ªa.
AstraZeneca se convirti¨® en el ¨²ltimo peso pesado en unirse al campo cuando, el 4 de junio, complet¨® la compra de Fusion Pharmaceuticals, fabricante de radiof¨¢rmacos de nueva generaci¨®n, en un acuerdo valorado en unos 2.400 millones de d¨®lares. La iniciativa sigue a transacciones similares de m¨¢s de 1.000 millones de d¨®lares realizadas en los ¨²ltimos meses por Bristol Myers Squibb (BMS) y Eli Lilly, junto con adquisiciones anteriores de empresas radiofarmac¨¦uticas innovadoras por parte de Novartis, que continu¨® su racha ¡ªiniciada en 2018¡ª con otra compra estimada en 1.000 millones de d¨®lares para una nueva empresa de radiofarmac¨¦uticos, como se revel¨® en mayo.
¡°Es incre¨ªble c¨®mo, de repente, est¨¢ de moda¡±, dice George Sgouros, f¨ªsico radiol¨®gico de la Facultad de Medicina de la Universidad Johns Hopkins, en Baltimore, y fundador de Rapid, una empresa con sede en esa ciudad que ofrece software y servicios de im¨¢genes para respaldar el desarrollo de radiof¨¢rmacos. Este auge, se?ala, subraya un reconocimiento m¨¢s amplio de que los radiof¨¢rmacos ofrecen ¡°una forma fundamentalmente diferente de tratar el c¨¢ncer¡±.
No obstante, tratar el c¨¢ncer de manera distinta significa navegar por un campo minado de desaf¨ªos ¨²nicos, en particular en la fabricaci¨®n y distribuci¨®n meticulosamente programada de estas nuevas terapias antes de que decaiga la radiactividad. Ampliar el alcance de la terapia para tratar una gama m¨¢s variada de c¨¢nceres tambi¨¦n requerir¨¢ aprovechar nuevos tipos de part¨ªculas que destruyen tumores y encontrar objetivos adecuados adicionales.
¡°Hay mucho potencial aqu¨ª¡±, dice David Nierengarten, analista que cubre el campo de los radiof¨¢rmacos para Wedbush Securities en San Francisco. Pero a?ade que ¡°todav¨ªa hay mucho margen para mejorar¡±.
Avances at¨®micos
Durante d¨¦cadas, una forma radiactiva de yodo fue el ¨²nico radiof¨¢rmaco disponible en el mercado. Una vez ingerido, este yodo es absorbido por la tiroides, donde ayuda a destruir las c¨¦lulas cancerosas de esa gl¨¢ndula con forma de mariposa ubicada en el cuello, una t¨¦cnica de tratamiento establecida en los a?os cuarenta que sigue siendo de uso com¨²n en la actualidad.
Pero la naturaleza dirigida de esta estrategia no es ampliamente aplicable a otros tipos de tumores.
La tiroides tiene una tendencia natural a absorber yodo del torrente sangu¨ªneo, pues este mineral, que se halla en su forma no radiactiva en muchos alimentos, es necesario para la s¨ªntesis de ciertas hormonas que produce la gl¨¢ndula.
Otros c¨¢nceres no tienen una afinidad comparable por los elementos radiactivos. Y as¨ª, en lugar de secuestrar las v¨ªas fisiol¨®gicas naturales, los investigadores han tenido que dise?ar f¨¢rmacos que sean capaces de reconocer y adherirse a prote¨ªnas espec¨ªficas producidas por c¨¦lulas tumorales. Luego, estos medicamentos se dise?an para que act¨²en como transportadores espec¨ªficos, entregando is¨®topos radiactivos ¡ª¨¢tomos inestables que emiten energ¨ªa nuclear¡ª directo al sitio maligno.

Los primeros agentes de este tipo que llegaron al mercado fueron estrictamente para obtener im¨¢genes de tejidos dentro del cuerpo. Utilizando is¨®topos relativamente benignos y de vida corta, estos productos permitieron la iluminaci¨®n precisa de tejidos cancerosos en estudios PET, ayudando a los m¨¦dicos a diagnosticar y ubicar c¨¦lulas malignas con mayor precisi¨®n. Esta innovaci¨®n allan¨® el camino para la aparici¨®n de radiof¨¢rmacos equipados con cargas radiactivas m¨¢s potentes ¡ªy letales¡ª, ahora con el objetivo no solo de obtener im¨¢genes de c¨¦lulas tumorales, sino tambi¨¦n de matarlas.
Sin embargo, la estrategia tard¨® tiempo en establecerse en el tratamiento rutinario del c¨¢ncer.
La primera terapia comercializada que combina is¨®topos radiactivos con una mol¨¦cula dirigida a las c¨¦lulas ¡ªun f¨¢rmaco llamado Quadramet, aprobado por los reguladores estadounidenses en 1997¡ª ofrec¨ªa un alivio paliativo para el dolor ¨®seo causado por el c¨¢ncer, pero no estaba dise?ada para reducir los tumores. Pocos m¨¦dicos la prescribieron.
A principios de la d¨¦cada de 2000 surgieron dos nuevos f¨¢rmacos para tratar el linfoma, ambos marcados con part¨ªculas radiactivas y dirigidos contra el CD20, un marcador de las c¨¦lulas sangu¨ªneas malignas. Aunque estos f¨¢rmacos funcionaron muy bien en los ensayos cl¨ªnicos, ayudando a reducir los tumores en una abrumadora mayor¨ªa de los participantes en los estudios, tuvieron dificultades para conseguir una aceptaci¨®n generalizada en la pr¨¢ctica cl¨ªnica. Ninguno de los dos pudo competir con el rituximab, un medicamento no radiactivo de gran ¨¦xito de ventas que tambi¨¦n act¨²a contra el CD20, por lo que finalmente dejaron de comercializarse. En la actualidad, ninguno de los dos est¨¢ disponible para los pacientes.
Despu¨¦s de estos reveses comerciales, el inter¨¦s por los radiof¨¢rmacos disminuy¨® y se estanc¨® la inversi¨®n en su desarrollo. ¡°En aquella ¨¦poca, las empresas farmac¨¦uticas no quer¨ªan tocar los agentes radioactivos ni con un palo de tres metros, aunque el palo fuera de plomo¡±, explica Neil H. Bander, fundador y director cient¨ªfico de Convergent Therapeutics, una startup dedicada a los radiof¨¢rmacos con sede en Cambridge, Massachusetts. ¡°El concepto de un f¨¢rmaco radiactivo era anatema para ellos¡±.
Pero los esfuerzos en las universidades continuaron, incluso en la Weill Cornell Medicine en Nueva York, donde Bander ¡ªque pas¨® 40 a?os en la facultad de medicina y ahora es profesor em¨¦rito¡ª comenz¨® a hacer ensayos con f¨¢rmacos de anticuerpos radiomarcados para tratar el c¨¢ncer de pr¨®stata, a partir del a?o 2000.
Estos medicamentos fueron dise?ados para unirse a una prote¨ªna receptora que se halla en la superficie de las c¨¦lulas del c¨¢ncer de pr¨®stata, conocida como ant¨ªgeno de membrana espec¨ªfico de la pr¨®stata (PSMA, por sus siglas en ingl¨¦s). Una vez unidos, estas c¨¦lulas los internalizan y entregan su carga radiactiva directamente al n¨²cleo gen¨¦tico de las c¨¦lulas tumorales. (Bander coescribi¨® un art¨ªculo sobre esta y otras terapias basadas en PSMA en el Annual Review of Medicine en 2024).
Opciones nucleares
En ese tiempo, en Europa, los m¨¦dicos estaban avanzando en el desarrollo de agentes radiomarcados dirigidos a otro objetivo: los receptores de somatostatina. Estas prote¨ªnas, que est¨¢n presentes en c¨¢nceres raros del sistema neuroendocrino, median la se?alizaci¨®n hormonal que puede impulsar el crecimiento tumoral. Investigadores descubrieron que mol¨¦culas que imitadoras de hormonas cargadas con is¨®topos radiactivos pod¨ªan unirse a estos receptores y reducir los tumores.
Los m¨¦dicos experimentaron con diferentes cargas radiactivas bajo protocolos de uso compasivo que permiten a los pacientes gravemente enfermos tener acceso a tratamientos experimentales, utilizando formas inestables de elementos como el itrio y el indio antes de fusionarse en gran medida alrededor de un is¨®topo de lutecio. Este metal de tierras raras se eligi¨® por ser menos da?ino para los ri?ones y tener una vida media m¨¢s larga, lo que beneficiaba la fabricaci¨®n y la log¨ªstica. En una cl¨ªnica de Bad Berka, Alemania, se trataron a m¨¢s de mil pacientes a lo largo de una d¨¦cada, lo que mostr¨® tasas de supervivencia extendidas en comparaci¨®n con el tratamiento convencional.
Paralelamente, varias empresas farmac¨¦uticas emergentes comenzaron a establecer las bases regulatorias para una aceptaci¨®n m¨¢s amplia. Una empresa francesa llamada Advanced Accelerator Applications (AAA) llev¨® un f¨¢rmaco marcado con lutecio a trav¨¦s de ensayos aleatorios y, en 2017, dio a conocer que esta terapia ralentiz¨® notablemente la progresi¨®n de los tumores intestinales en comparaci¨®n con el est¨¢ndar de atenci¨®n existente. El f¨¢rmaco, comercializado como Lutathera, r¨¢pidamente obtuvo la aprobaci¨®n de los reguladores europeos y estadounidenses.
Fue entonces cuando Novartis tom¨® nota. Aunque el gigante farmac¨¦utico suizo hab¨ªa incursionado en los radiof¨¢rmacos en el pasado, en ese momento lo hizo de lleno. A las pocas semanas de que Lutathera obtuviera el visto bueno en Europa, Novartis r¨¢pidamente cerr¨® un acuerdo para adquirir AAA por casi 4.000 millones de d¨®lares. Un a?o despu¨¦s, incorpor¨® una peque?a empresa de Indiana llamada Endocyte por m¨¢s de 2.000 millones de d¨®lares m¨¢s. ¡°Fue como si alguien hubiera accionado un interruptor¡±, dice Bander. El revitalizado inter¨¦s de la industria por los radiof¨¢rmacos se hab¨ªa acelerado de repente.

La adquisici¨®n de Endocyte trajo un agente dirigido al PSMA que resultar¨ªa ser una verdadera revoluci¨®n, tanto para los pacientes con ciertos casos de c¨¢ncer de pr¨®stata avanzado y dif¨ªciles de tratar, como para las ganancias de Novartis.
Un ensayo cl¨ªnico aleatorio descubri¨® que cuando el medicamento se agreg¨® a la atenci¨®n est¨¢ndar duplic¨® con creces el tiempo promedio antes de la progresi¨®n de la enfermedad ¡ªde menos de cuatro meses a m¨¢s de ocho¡ª y tambi¨¦n extendi¨® la esperanza de vida de los receptores en varios meses.
Debe destacarse que Lutathera tambi¨¦n hab¨ªa mostrado una eficacia cl¨ªnica impresionante. Pero los tumores neuroendocrinos son raros, y esta baja frecuencia significa que Lutathera nunca podr¨ªa alcanzar el tan codiciado umbral de ¡°¨¦xito de taquilla¡± de generar mil millones de d¨®lares en ventas por a?o. En comparaci¨®n, el tratamiento de pr¨®stata dirigido a PSMA, aprobado en 2022 bajo la marca Pluvicto, combate una enfermedad tan com¨²n que aproximadamente uno de cada siete hombres recibir¨¢ ese diagn¨®stico durante su vida. Como tal, estuvo a solo 20 millones de d¨®lares de alcanzar el estatus de ¨¦xito de taquilla menos de dos a?os despu¨¦s de su debut en el mercado.
Versi¨®n beta
Tanto Pluvicto como Lutathera se fabrican alrededor de peque?as secuencias de prote¨ªnas, conocidas como p¨¦ptidos. Estos p¨¦ptidos se unen espec¨ªficamente a receptores espec¨ªficos en las c¨¦lulas cancerosas (PSMA en el caso del c¨¢ncer de pr¨®stata y receptores de somatostatina en el caso de Lutathera) y administran radiaci¨®n a trav¨¦s de la desintegraci¨®n del lutecio inestable.
Infundidos en el torrente sangu¨ªneo, estos medicamentos circulan por todo el cuerpo hasta que se adhieren firmemente a la superficie de las c¨¦lulas tumorales que encuentran. Anclado en estos sitios objetivo, el is¨®topo de lutecio libera dos tipos de radiaci¨®n que ayudan en el tratamiento del c¨¢ncer. La emisi¨®n primaria consiste en part¨ªculas beta, electrones de alta energ¨ªa capaces de penetrar tumores y c¨¦lulas circundantes, ingresar al ADN y causar da?os que, en ¨²ltima instancia, desencadenan la muerte celular.
Los rayos gamma, tambi¨¦n producidos en menores cantidades, no causan mucho da?o a los tejidos pero permiten a los proveedores de atenci¨®n m¨¦dica rastrear en tiempo real d¨®nde se distribuye el medicamento en el cuerpo. Esto ayuda a monitorear el progreso del tratamiento y ajustar las estrategias en consecuencia. ¡°De hecho, puedes visualizar d¨®nde va la dosis y tener una mejor comprensi¨®n¡±, dice Thomas Hope, especialista en medicina nuclear de la Universidad de California en San Francisco, quien fue consultor de RayzeBio (antes de su adquisici¨®n por parte de BMS a principios de este a?o), adem¨¢s de otros fabricantes de radiof¨¢rmacos no mencionados en este art¨ªculo.
Muchas otras terapias que est¨¢n actualmente en ensayos cl¨ªnicos tambi¨¦n utilizan lutecio radiactivo y otros is¨®topos emisores de beta. Pero los actuales esfuerzos de investigaci¨®n y las importantes inversiones de la industria se est¨¢n desplazando progresivamente hacia medicamentos que dependen de is¨®topos emisores de alfa.
En comparaci¨®n con las part¨ªculas beta, las part¨ªculas alfa son m¨¢s grandes y m¨¢s energ¨¦ticas. Esta caracter¨ªstica les permite fragmentar el ADN rompiendo ambas hebras de la doble h¨¦lice, lo que lleva a una aniquilaci¨®n celular altamente localizada. ¡°Es b¨¢sicamente como una bala de ca?¨®n que explota dentro de la c¨¦lula¡±, dice John Valliant, fundador y director ejecutivo de Fusion Pharmaceuticals, una empresa canadiense cuyos radiof¨¢rmacos emisores alfa fueron el atractivo de la reciente adquisici¨®n de la empresa por parte de AstraZeneca.
Otra ventaja clave de las part¨ªculas alfa es su limitada distancia de deplazamiento. Suelen penetrar solo entre 50 y 100 micr¨®metros, aproximadamente el ancho de un cabello humano. Esto contrasta fuertemente con las part¨ªculas beta, que pueden atravesar mil¨ªmetros de tejido antes de que se agote su energ¨ªa. Como resultado, las terapias que emplean part¨ªculas alfa logran efectos altamente localizados: devastan el tejido tumoral y evitan lesiones a las c¨¦lulas sanas cercanas.
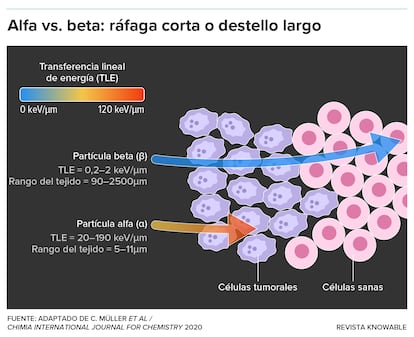
La salida de los alfa
Algunos de los primeros radiof¨¢rmacos emisores alfa que entren al mercado probablemente estar¨¢n dirigidos contra el c¨¢ncer de pr¨®stata a trav¨¦s del PSMA. Los desarrolladores son optimistas de que estos agentes eventualmente eclipsar¨¢n a Pluvicto, y est¨¢n agregando caracter¨ªsticas adicionales para mejorar la efectividad.
En Convergent, por ejemplo, Bander y su equipo est¨¢n desarrollando un f¨¢rmaco mucho m¨¢s grande basado en un anticuerpo conectado a un is¨®topo liberador de alfa. Debido a su tama?o y complejidad, el f¨¢rmaco permanece en el cuerpo mucho m¨¢s tiempo que sus hom¨®logos basados en p¨¦ptidos, que tienden a ser eliminados r¨¢pidamente por los ri?ones. Eso significa m¨¢s tiempo para que el f¨¢rmaco encuentre su objetivo y mate las c¨¦lulas tumorales. Adem¨¢s, los anticuerpos emisores alfa contra el PSMA parecen causar menos da?o a las gl¨¢ndulas salivales en comparaci¨®n con sus hom¨®logos pept¨ªdicos, lo que proporciona un posible beneficio adicional en materia de seguridad.
Pero la destrucci¨®n celular precisa de los emisores alfa puede no ser siempre ventajosa, seg¨²n Chris Behrenbruch, director ejecutivo de Telix Pharmaceuticals en el norte de Melbourne, Australia. La elecci¨®n de la carga radiactiva, dice, deber¨ªa estar influenciada por el estado de la enfermedad y por otras terapias que est¨¦ recibiendo el paciente a trav¨¦s de reg¨ªmenes de medicamentos combinados que se est¨¢n volviendo cada vez m¨¢s est¨¢ndar en la atenci¨®n del c¨¢ncer.
Y a medida que los m¨¦dicos comienzan a explorar el potencial de los tratamientos radiofarmac¨¦uticos cuando se combinan con otros agentes que estimulan reacciones inmunitarias antitumorales, Behrenbruch propone que causar alg¨²n da?o al tejido circundante podr¨ªa en realidad ser deseable. Esto se debe a que el da?o ayuda a atraer c¨¦lulas T que combaten los tumores. ¡°Nada molesta m¨¢s al sistema inmunol¨®gico que la irradiaci¨®n de tejido sano¡±, comenta.
Telix ahora est¨¢ explorando esta hip¨®tesis, realizando ensayos cl¨ªnicos que combinan un anticuerpo marcado con lutecio que se dirige a una enzima producida por c¨¦lulas de c¨¢ncer de ri?¨®n con un f¨¢rmaco de inmunoterapia dise?ado para acelerar las c¨¦lulas T del cuerpo. Al apuntar a un objetivo novedoso, el f¨¢rmaco radiactivo de Telix tambi¨¦n corre el riesgo de infligir da?os colaterales, dado que las c¨¦lulas sanas del est¨®mago, el p¨¢ncreas y la ves¨ªcula biliar ¡ªno solo las c¨¦lulas cancerosas del ri?¨®n¡ª tambi¨¦n producen la enzima objetivo. Los datos de los ensayos iniciales indican que el tratamiento es, en general, tolerable, se?ala Behrenbruch. Aun as¨ª, se necesita investigaci¨®n continua para evaluar de manera integral su perfil de seguridad.
El desaf¨ªo de la especificidad ¡ªdirigir ¨²nicamente a las c¨¦lulas cancerosas sin afectar el tejido sano¡ª no es aislado para este caso. M¨¢s all¨¢ de los receptores de PSMA y somatostatina, el repertorio de prote¨ªnas expresadas de manera exclusiva o predominante por c¨¦lulas tumorales es notablemente peque?o, se?ala Ken Herrmann, especialista en medicina nuclear del Hospital Universitario de Essen, en Alemania. Esta selecci¨®n limitada complica el desarrollo de terapias que puedan atacar eficazmente los tumores sin imponer de forma accidental un da?o indebido a los tejidos sanos circundantes, dice Herrmann, que asesora a la mayor¨ªa de las principales compa?¨ªas farmac¨¦uticas en el sector, adem¨¢s de varias empresas biotecnol¨®gicas m¨¢s peque?as.
¡°Todo el mundo est¨¢ trabajando en nuevos objetivos¡±, se?ala. ¡°?Pero cu¨¢l de ellos ser¨¢ el ganador? No lo sabemos¡±.
Novartis est¨¢ entre los l¨ªderes en la b¨²squeda competitiva para identificar los pr¨®ximos objetivos revolucionarios. La compa?¨ªa est¨¢ buscando una nueva generaci¨®n de medicamentos radiomarcados dirigidos contra varias prote¨ªnas prometedoras selectivas para el c¨¢ncer, algunas de las cuales ya est¨¢n en evaluaci¨®n cl¨ªnica y otras en etapas anteriores de descubrimiento y validaci¨®n. Al mismo tiempo, la empresa est¨¢ ampliando sus capacidades de fabricaci¨®n, con la apertura de nuevas instalaciones en todo el mundo dise?adas espec¨ªficamente para la producci¨®n en masa de radiof¨¢rmacos.
Y es que no es como fabricar otros tipos de medicamentos contra el c¨¢ncer. Los problemas en la cadena de suministro son comunes, como descubri¨® Bristol Myers Squibb a principios de junio cuando una escasez de is¨®topos oblig¨® a la compa?¨ªa a suspender temporalmente la inscripci¨®n de pacientes en la ¨²ltima etapa de un ensayo de un agente radiofarmac¨¦utico adquirido recientemente de RayzeBio. Adem¨¢s, incluso cuando los is¨®topos necesarios est¨¢n a la mano, la r¨¢pida desintegraci¨®n del material radiactivo obliga a las empresas a operar dentro de un marco log¨ªstico ¨²nico, con una coordinaci¨®n meticulosa entre m¨¦dicos y fabricantes para que los medicamentos lleguen a los hospitales dentro de per¨ªodos estrictamente definidos mientras las terapias siguen siendo potentes.
En general, las empresas tienen un per¨ªodo de planificaci¨®n de dos semanas para producir un radiois¨®topo, adjuntarlo a un transportador de f¨¢rmaco dirigido y enviar la terapia para su administraci¨®n. No es exactamente una fabricaci¨®n hecha a medida y por encargo. Pero tampoco es un producto disponible en el mercado. Est¨¢ en alg¨²n punto intermedio, y cada dosis a menudo se administra ¡°para un paciente espec¨ªfico en un momento espec¨ªfico y en un lugar espec¨ªfico¡±, se?ala Jeevan Virk, quien supervisa el desarrollo de f¨¢rmacos radioterap¨¦uticos en Novartis.
A principios de este a?o, Novartis inaugur¨® una instalaci¨®n de fabricaci¨®n de 100 millones de d¨®lares en Indian¨¢polis, donde la compa?¨ªa prev¨¦ producir cientos y posiblemente miles de dosis de Pluvicto todos los d¨ªas. Est¨¢ muy lejos de aquella rudimentaria f¨¢brica de bombillas de luz en Chicago donde, a solo unas horas en auto, Rose Lee se convirti¨® en la primera paciente con c¨¢ncer tratada con rayos X. En estos sitios de innovaci¨®n del Medio Oeste de los Estados Unidos, se proyecta la historia, conectando descubrimientos pasados con posibilidades futuras.
Art¨ªculo traducido por Daniela Hirschfeld.
Este art¨ªculo apareci¨® originalmente en Knowable en espa?ol, una publicaci¨®n sin ¨¢nimo de lucro dedicada a poner el conocimiento cient¨ªfico al alcance de todos.
Puedes seguir a EL PA?S Salud y Bienestar en Facebook, X e Instagram.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
?Tienes una suscripci¨®n de empresa? Accede aqu¨ª para contratar m¨¢s cuentas.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.