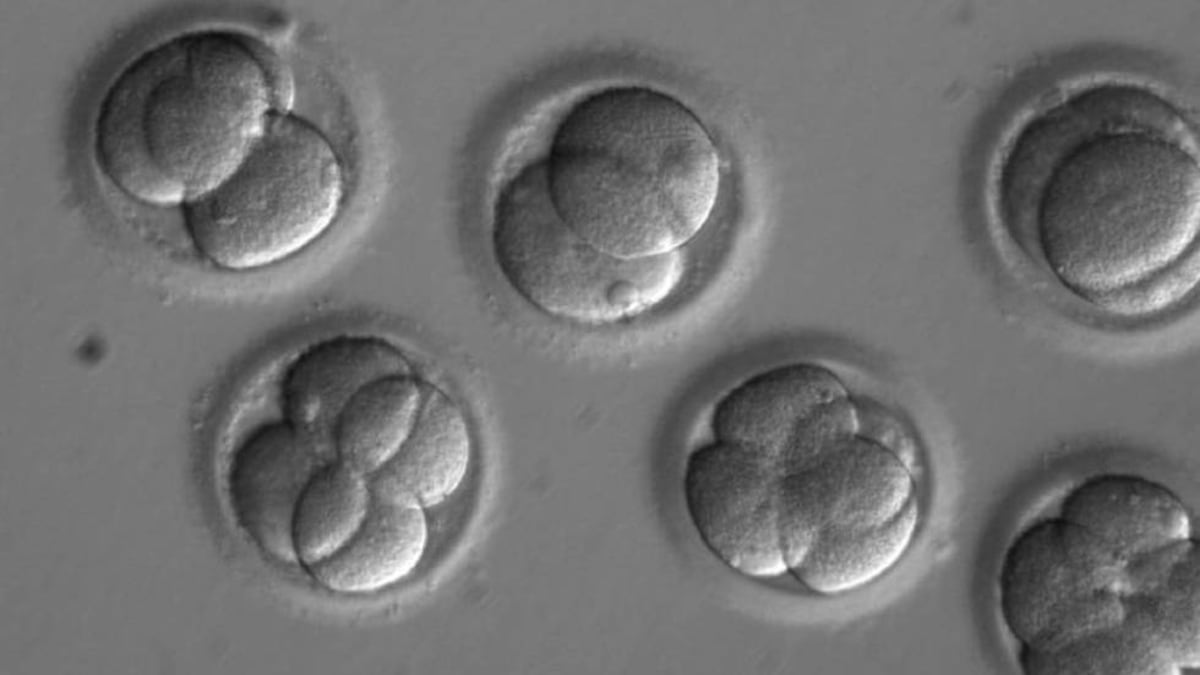
Cient¨ªficos de varios pa¨ªses corrigen una enfermedad hereditaria en embriones humanos
La t¨¦cnica CRISPR elimina la causa gen¨¦tica de la muerte s¨²bita
Cient¨ªficos en EE UU, Corea del Sur y China han conseguido eliminar con ¨¦xito una enfermedad hereditaria en embriones humanos por primera vez. La investigaci¨®n supone un paso fundamental hacia futuras terapias para corregir ciertos tipos de c¨¢ncer as¨ª como unas 10.000 enfermedades raras que surgen cuando una de las dos copias de un gen es err¨®nea. Tambi¨¦n es una llamada de atenci¨®n a toda la sociedad, pues la t¨¦cnica permite al ser humano cambiar su destino biol¨®gico al introducir cambios en las c¨¦lulas germinales ¡ª¨®vulos, espermatozoides y embriones¡ª que se transmitir¨¢n para siempre de generaci¨®n en generaci¨®n.
Los investigadores se han centrado en la miocardiopat¨ªa hipertr¨®fica, una dolencia del coraz¨®n frecuente que provoca muerte s¨²bita en deportistas y personas j¨®venes. Una de las causas principales de la dolencia es que una de las dos copias del gen MYBPC3 es err¨®nea.
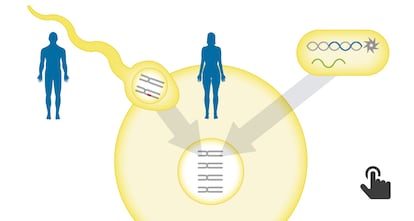
Los cient¨ªficos han usado CRISPR, una tecnolog¨ªa que permite modificar el genoma de cualquier ser vivo con mucha facilidad, para corregir la mutaci¨®n en espermatozoides de un hombre portador de la enfermedad. Los cient¨ªficos inyectaron al mismo tiempo los espermatozoides y una secuencia de CRISPR con la versi¨®n correcta del gen en ¨®vulos donados por mujeres sanas. De los 58 embriones resultantes, 42 se desarrollaron sin la mutaci¨®n que causa la enfermedad, una tasa de ¨¦xito del 72%. Por primera vez se ha logrado que un n¨²mero sustancial de embriones sean totalmente viables, sin errores gen¨¦ticos adicionales que podr¨ªan causar problemas de salud en un futuro beb¨¦ y en sus descendientes. Ninguno de los embriones estaba destinado a implantarse por lo que fueron destruidos en unos d¨ªas tras la investigaci¨®n.
En 2015, cient¨ªficos chinos fueron los primeros en modificar embriones humanos con esta t¨¦cnica. El trabajo m¨¢s reciente, publicado este a?o, consigui¨® corregir un gen que provoca la beta-talasemia, un tipo de anemia. Pero ninguno de los tres trabajos consigui¨® curar todas las c¨¦lulas del embri¨®n, solo una parte, un problema conocido como mosaicismo, ni evitar mutaciones adicionales en el genoma, lo que desaconsejaba un posible uso terap¨¦utico. Las investigaciones tambi¨¦n originaron un debate internacional sobre los l¨ªmites ¨¦ticos que hay que imponer a esta tecnolog¨ªa y los cauces legales para aplicarla en los casos adecuados.
Por primera vez se ha logrado que un n¨²mero sustancial de embriones sean totalmente viables
El avance ¡°abre las puertas a que esta tecnolog¨ªa pudiera llevarse alguna d¨ªa a la cl¨ªnica, obviamente con todas las precauciones necesarias y siempre si hubiera consenso en la sociedad y la ley as¨ª lo permitiera¡±, se?ala el bioqu¨ªmico espa?ol Juan Carlos Izpis¨²a, investigador del Instituto Salk y coautor de la investigaci¨®n, publicada hoy en la revista Nature.
El trabajo es fruto de la colaboraci¨®n entre los mayores expertos mundiales en los diferentes campos implicados. La manipulaci¨®n de los embriones se ha realizado en la Universidad de Salud y Ciencia de Oreg¨®n (EE UU) y ha sido liderada por Shoukhrat Mitalipov, quien ya consigui¨® la primera clonaci¨®n terap¨¦utica humana. Entre los firmantes tambi¨¦n est¨¢ el experto en edici¨®n gen¨¦tica Jin-Soo Kim, del Instituto de Ciencia B¨¢sica de Corea del Sur, as¨ª como varios autores del Instituto de Gen¨®mica de Pek¨ªn y el Laboratorio de Ingenier¨ªa de Diagn¨®stico Molecular Innovador de Shenzhen, que han analizado el genoma de los embriones para comprobar que no portaban errores.
La clave del ¨¦xito estaba en inyectar el CRISPR junto con el esperma en el ¨®vulo y no despu¨¦s, cuando ya se ha formado un embri¨®n, como hicieron los investigadores chinos. ¡°Si lo haces en este estad¨ªo el proceso es casi perfecto, funciona siempre, pero habr¨¢ que ver si funciona igual de bien en cada caso particular¡±, explica Izpis¨²a, cuyo equipo en el Salk ha supervisado la edici¨®n g¨¦nica de las c¨¦lulas y embriones.
La t¨¦cnica a¨²n no est¨¢ lista para usarse en personas. El pr¨®ximo paso ser¨¢ mejorar su eficiencia. El diagn¨®stico preimplantacional, que permite analizar el genoma de un embri¨®n generado por fecundaci¨®n in vitro antes de ser implantado en la madre, tiene una tasa de ¨¦xito del 50% (solo la mitad de los espermatozoides lleva el gen defectuoso). El uso de CRISPR eleva ahora esa tasa por encima del 70%, lo que permitir¨ªa, por ejemplo, desechar menos embriones en los procesos de reproducci¨®n asistida. Pero lo deseable es llegar al 90% o incluso el 100% de efectividad antes de pensar en aplicarla en humanos, explic¨® ayer Mitalipov durante una conferencia de prensa.
Probar la t¨¦cnica en personas requiere cambiar las leyes que regulan la reproducci¨®n asistida y la investigaci¨®n en muchos pa¨ªses, incluida Espa?a
Otro paso inminente del equipo es corregir las mutaciones en los genes BRCA1 y 2, asociados a un riesgo muy alto de c¨¢ncer de mama y ovario, usando la misma t¨¦cnica. En un paso m¨¢s lejano, habr¨ªa que realizar ensayos cl¨ªnicos para trasplantar ¡°los embriones a las madres y despu¨¦s seguir la salud de sus hijos¡±, explic¨® ayer Mitalipov. Este ensayo ¡°requerir¨ªa acuerdos parlamentarios para cambiar las leyes de EE UU y muchos otros pa¨ªses. Queda a¨²n un largo camino por delante¡±, advirti¨®.
Izpis¨²a vislumbra dos futuras aplicaciones de esta tecnolog¨ªa. La primera ser¨ªa en ¡°los precursores de los gametos masculinos y femeninos para parejas con s¨ªndromes recesivos muy severos. De esta manera, la correcci¨®n g¨¦nica no se har¨ªa en el embri¨®n, sino en las c¨¦lulas precursoras de los gametos, y se mitigar¨ªan ciertos aspectos ¨¦ticos y de seguridad¡±, explica. Con esta intervenci¨®n se podr¨ªan corregir, por ejemplo, las mutaciones de c¨¢ncer de mama y ovario.

La segunda opci¨®n es usar el CRISPR directamente en el ¨²tero para corregir ¡°enfermedades gen¨¦ticas severas, como la trisom¨ªa que origina el s¨ªndrome de Down, en estados de gestaci¨®n avanzados¡±, detalla. En estos casos el proceso no ser¨ªa perfecto, pues no se corregir¨¢n todas las c¨¦lulas del feto. Pero s¨ª se podr¨ªa dirigir el CRISPR a los ¨®rganos m¨¢s afectados, por ejemplo cerebro y coraz¨®n, con la esperanza de cambiar suficientes c¨¦lulas como para corregir el problema. ¡°A¨²n nos falta bastante investigaci¨®n, por ahora hablamos de corregir una sola mutaci¨®n, con lo que esta tecnolog¨ªa no ser¨ªa extensible a otros problemas¡±, advierte Izpis¨²a.
El bioqu¨ªmico espa?ol fue uno de los miembros de un panel internacional de cient¨ªficos reunido por la Academia de Ciencias de EE UU que public¨® un documento a principios de este a?o se?alando qu¨¦ usos de CRISPR deben ser permitidos. La tecnolog¨ªa, dec¨ªan, debe usarse solo en los casos en los que sea el ¨²ltimo recurso para evitar enfermedades graves y nunca para intentar mejorar las capacidades f¨ªsicas o mentales de un individuo, algo que, para Izpis¨²a, ni siquiera ser¨ªa posible desde el punto de vista t¨¦cnico hoy por hoy. ¡°Lo que m¨¢s me preocupa es que estas tecnolog¨ªas sean de utilidad para todos, como lo han sido las vacunas, y no solo para los ricos¡±, comenta.
El trabajo deja tambi¨¦n una importante sorpresa desde el punto de vista del conocimiento b¨¢sico de la biolog¨ªa humana. Las secuencias de CRISPR contienen unas gu¨ªas de ARN que buscan el punto exacto del genoma sobre el que hay que intervenir y unas enzimas que cortan el fragmento defectuoso. La secuencia tambi¨¦n incluye una plantilla con la versi¨®n correcta del gen. Una vez cortado el genoma, los mecanismos naturales de reparaci¨®n de la c¨¦lula vuelven a pegar la secuencia gen¨¦tica a?adiendo la versi¨®n proporcionada. La gran sorpresa es que los ¨®vulos no usan la versi¨®n introducida por CRISPR, sino que duplica la propia copia correcta del gen que ya porta en su genoma.
Este fen¨®meno no se hab¨ªa observado antes ni en animales de laboratorio ni en las c¨¦lulas som¨¢ticas humanas, las que dan lugar a todos los tejidos del cuerpo, lo que apunta a que las c¨¦lulas reproductoras tienen un mecanismo ¨²nico y robust¨ªsimo de autoprotecci¨®n que no se lleva bien con adiciones externas. Desde un punto de vista evolutivo tiene todo el sentido, pues son las c¨¦lulas encargadas de perpetuar la especie. Una de las primeras preguntas a responder es si esto impide corregir defectos gen¨¦ticos cuando estos est¨¢n en el ¨®vulo y no en el espermatozoide.
Escasas aplicaciones en el corto plazo
Esta investigaci¨®n no habr¨ªa sido posible en Espa?a. La ley proh¨ªbe expresamente crear embriones para investigaci¨®n. Solo se pueden usar aquellos que sean descartados en las cl¨ªnicas de reproducci¨®n asistida. El r¨¢pido avance de la tecnolog¨ªa ¡ªCRISPR fue el descubrimiento del a?o en 2015¡ª pilla por sorpresa a la sociedad y los gobernantes. "Esto era algo que ten¨ªa que pasar", se?ala ?ngel Raya, presidente electo de la Sociedad Espa?ola de Terapia G¨¦nica y Celular. "Ahora tenemos que pensar para qu¨¦ queremos usarlo. Modificar la l¨ªnea germinal a prop¨®sito es una barrera ¨¦tica en muchos pa¨ªses y es la sociedad la que debe decidir. Se trata de una decisi¨®n grande porque define el futuro de la humanidad", opina el tambi¨¦n director del Centro de Medicina Regenerativa de Barcelona.
La raz¨®n es que hay peligro de introducir cambios irreversibles en la descendencia. "Si hay alg¨²n defecto, ?qu¨¦ habr¨ªa que hacer, impedir a esa persona tener hijos o eliminar a su descendencia?", reflexiona Raya. En su opini¨®n, "la ¨²nica justificaci¨®n posible ser¨ªa cuando hay una enfermedad que no se puede solucionar de otra forma". El problema, a?ade, es que por ahora "apenas se conocen casos en los que supondr¨ªa una ventaja significativa respecto al diagn¨®stico preimplantacional".
Este logro es ¡°sorprendente y preocupante a la vez¡±, se?ala Llu¨ªs Montoliu, miembro del comit¨¦ de bio¨¦tica del Consejo Superior de Investigaciones Cient¨ªficas. ¡°Son unos resultados muy convincentes y demuestran que para reparar un gen no hace falta ni siquiera un factor ex¨®geno, el propio ¨®vulo lo repara¡±, a?ade. ¡°Lo preocupante es que esta investigaci¨®n tambi¨¦n contraviene el Protocolo de Oviedo", un pacto europeo sobre medicina y biolog¨ªa firmado por 29 pa¨ªses, incluida Espa?a, "y en el que no est¨¢n EE UU, China ni Reino Unido¡±, se?ala.
Montoliu tambi¨¦n advierte de que la aplicaci¨®n de esta t¨¦cnica en gametos ¡°solo ser¨ªa ¨²til en un reducid¨ªsimo n¨²mero de casos¡±, en el resto el diagn¨®stico preimplantacional permitir¨ªa identificar y descartar los embriones con defectos gen¨¦ticos. Lo realmente importante es la futura aplicaci¨®n a las c¨¦lulas som¨¢ticas. Estudios en ratones han demostrado que CRISPR permite revertir 10 enfermedades monog¨¦nicas?¡ªcausadas por un solo gen¡ª diferentes, dice Montoliu. Si esto se consigue trasladar a humanos, se beneficiar¨ªa ¡°un n¨²mero mucho m¨¢s elevado de pacientes¡±, resalta.
Tu suscripci¨®n se est¨¢ usando en otro dispositivo
?Quieres a?adir otro usuario a tu suscripci¨®n?
Si contin¨²as leyendo en este dispositivo, no se podr¨¢ leer en el otro.
FlechaTu suscripci¨®n se est¨¢ usando en otro dispositivo y solo puedes acceder a EL PA?S desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripci¨®n a la modalidad Premium, as¨ª podr¨¢s a?adir otro usuario. Cada uno acceder¨¢ con su propia cuenta de email, lo que os permitir¨¢ personalizar vuestra experiencia en EL PA?S.
En el caso de no saber qui¨¦n est¨¢ usando tu cuenta, te recomendamos cambiar tu contrase?a aqu¨ª.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrar¨¢ en tu dispositivo y en el de la otra persona que est¨¢ usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aqu¨ª los t¨¦rminos y condiciones de la suscripci¨®n digital.
Sobre la firma